邮箱地址
前沿资讯
发布时间:2024-01-08 15:29:31 作者:青岛海大海洋寡糖科技有限公司 来源:本站
本文基于《Alginate-based drug carrier systems to target inflammatory bowel disease: A review》[1]进行写作,仅作为文献分享。
炎性肠炎
炎症性肠病(IBD)是一种影响胃肠道的炎症性疾病,通过改变肠道微生物群和下调宿主的免疫系统而导致消化道严重炎症。IBD主要被分为两种类型:①克罗恩病(CD):CD的特点是炎症主要发生在胃肠道;②溃疡性结肠炎(UC):UC的特点是炎症主要发生在直肠,然后发展到结肠。虽然UC和CD都会导致肠道屏障的破坏,但CD是由肠腔内的抗原和颗粒流入引起的,而UC是由肠道细菌的渗透引起的,然后这些细菌招募中性粒细胞并形成隐窝脓肿。目前,研究表明遗传、环境和微生物因素都与IBD的发生和发展有关。在遗传易感性人群中,IBD很可能是由对肠道菌群的异常免疫反应引起的。治疗IBD的传统方法包括免疫调节剂、皮质类固醇、氨基水杨酸酯和生物制剂。近年来随着纳米制剂的发展,基于纳米颗粒(NP)的药物递送研究也被应用于减轻和治疗IBD。
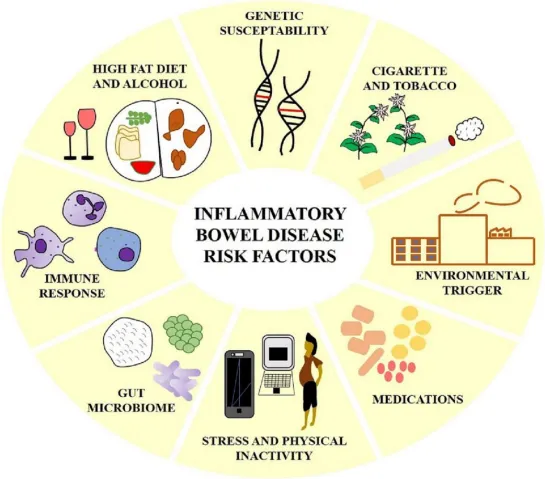
图1炎症性肠病风险因素示意图
纳米技术在缓解IBD方面的优势
IBD的药物治疗主要依赖于使用免疫抑制和抗炎化合物,但长期使用会产生毒副作用及耐受性。口服纳米药物可在不损害健康组织的情况下靶向治疗部位,同时由于NPs尺寸小,可有效穿透炎症细胞及肠道上皮细胞,可用于给药治疗IBD,具有治疗效率高、胃肠道稳定和靶向性强等优点。最近的研究还表明,纳米技术可用于开发IBD诊断和癌症诊断的纳米传感器,纳米技术与成像技术相结合,可实现IBD的早期诊断和疾病严重程度的监测。
褐藻胶作为纳米制剂载体的优点
褐藻胶(alginate,AG)是从褐藻提取得到的,由α-1,4-甘露糖醛酸和β-1,4古罗糖醛酸交替连接而成的多糖。褐藻胶是一种阴离子聚合物,与阳离子药物和聚合物具有很强的结合能力,可以提高封装效率。褐藻胶很容易与Ba2+和Ca2+等二甲阳离子结合,形成G-block复合物和稳定的水凝胶,在生物医药领域有多种应用,如可调节药物释放并实现蛋白质封装。同时,褐藻胶具有无毒、生物相容性好、不产生免疫原性、具有一定的机械强度等特点,广泛应用于抗真菌药物、组织工程3D打印、止血和促进伤口愈合的材料等。AG给药系统相较于传统的合成给药方案更安全、更有效,对环境的危害也更小。AG还可与其他多糖形成复杂相互作用,从而可以定制给药系统的特性,提高治疗效率。同时,AG具有很强的粘附性和穿透肠上皮的能力,因此基于AG的载体系统可用于治疗肠道疾病,能有效地为搭载的药物提供持续释放动力学。
AG载体系统搭载市售药物的治疗方法
5-氨基水杨酸是临床治疗UC的常用药物,但其高剂量下会引起恶心、疲劳和疼痛等副作用。在Mladenovska等人[2]进行的一项研究中,开发了一种基于CS-AG的新型微粒子系统,可以将5-氨基水杨酸特异性地输送到结肠中,结果显示,大小均匀的微颗粒可特异性地在结肠中定位,全身生物利用度较低。
皮质类固醇是一类与细胞核中的糖皮质激素受体相互作用以调节抗炎反应的药物,可与美沙拉嗪联用治疗IBD,但大多数IBD患者由于纤维化而对糖皮质激素无效,导致对抗炎药物缺乏反应,Samak等人[3]对用均质化和气溶胶法生产的AG微粒进行了比较分析,以给药皮质类固醇。与匀浆法生产的微粒相比,气溶胶法生产的微粒在胃pH值方面表现出更好的保护作用。与气溶胶微粒相比,均质化微粒的药物释放效果更好。这两种微粒都表现出特定部位给药和对pH值的敏感性。
甲氨蝶呤是一种免疫调节剂,但不能作为单一药物使用,只能与其他药物联合用于治疗IBD,不过载体系统可以为甲氨蝶呤提供有效的给药模式。在Sun等人的研究中[4],甲氨蝶呤被载入AG相关葡聚糖颗粒,实验结果表明该颗粒能有效下调促炎细胞因子并维持肠道巨噬细胞的平衡。
益生菌是保护人体肠道健康的重要生物。研究表明,益生菌通过介导Toll样受体来刺激Th1细胞分化,从而改变粘膜免疫系统,可调节肠道微生物群,恢复菌群平衡,缓解IBD炎症。Alkushi等人[5]和Zhou等人[6]最近的研究表明,将淀粉样芽孢杆菌和大肠杆菌等多种细菌菌株有效封装在基于CS-AG的共聚物载体系统中,能抵御胃酸pH值的影响,增强细菌的活力和功能。与单独服用益生菌相比,CS-AG载体可有效提高疗效和改善恢复情况。
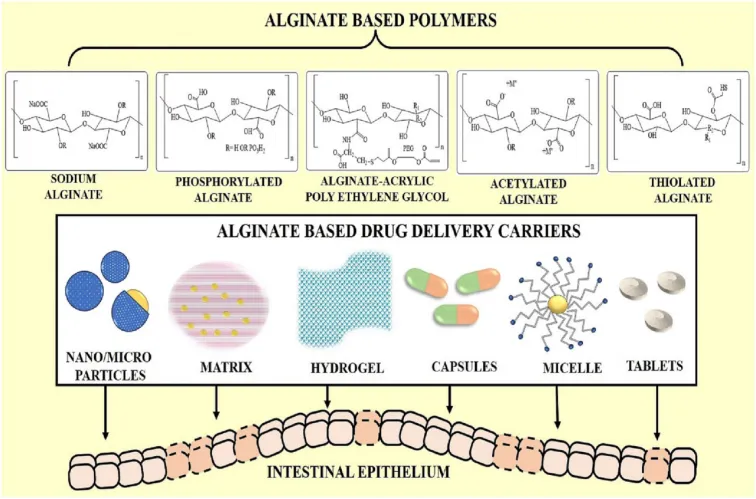
图2 缓解肠道相关炎症疾病的藻酸盐药物输送载体系统示意图
参考文献
[1] Swastha D, Varsha N, Aravind S, et al. Alginate-based drug carrier systems to target inflammatory bowel disease: A review. Int J Biol Macromol. 2023;244:125472. doi:10.1016/j.ijbiomac.2023.125472
[2] K. Mladenovska, R.S. Raicki, E.I. Janevik, T. Ristoski, M.J. Pavlova, Z. Kavrakovski, M.G. Dodov, K. Goracinova, Colon-specific delivery of 5-aminosalicylic acid from chitosan-Ca-alginate microparticles, Int. J. Pharm. 342 (2007) 124–136, https://doi.org/10.1016/j.ijpharm.2007.05.028.
[3] Y.O. Samak, M. El Massik, A.G.A. Coombes, A comparison of aerosolization and homogenization techniques for production of alginate microparticles for delivery of corticosteroids to the colon, J. Pharm. Sci. 106 (2017) 208–216, https://doi.org/10.1016/j.xphs.2016.08.015.
[4] Y. Sun, B. Duan, H. Chen, X. Xu, A novel strategy for treating inflammatory bowel disease by targeting delivery of methotrexate through glucan particles, Adv.
Healthc. Mater. 9 (2020), e1901805, https://doi.org/10.1002/adhm.201901805.
[5] A.G. Alkushi, A. Abdelfattah-Hassan, H. Eldoumani, S.T. Elazab, S.A. M. Mohamed, A.S. Metwally, E.S. El-Shetry, A.A. Saleh, N.A. ElSawy, D. Ibrahim, Probiotics-loaded nanoparticles attenuated colon inflammation, oxidative stress, and apoptosis in colitis, Sci. Rep. 12 (2022) 5116, https://doi.org/10.1038/ s41598-022-08915-5
[6] J. Zhou, M. Li, Q. Chen, X. Li, L. Chen, Z. Dong, W. Zhu, Y. Yang, Z. Liu, Q. Chen, Programmable probiotics modulate inflammation and gut microbiota for inflammatory bowel disease treatment after effective oral delivery, Nat. Commun. 13 (2022) 3432, https://doi.org/10.1038/s41467-022-31171-0.
作者:汪浩
审核:李全才,吕友晶
编辑:邵萌
如有侵权,请联系删除