邮箱地址
前沿资讯
发布时间:2024-03-18 10:50:07 作者:青岛海大海洋寡糖科技有限公司 来源:本站
文章题目:Heparin is essential for optimal cell signaling by FGF21 and for regulation of βKlotho cellular stability
发表期刊 :PNAS
影响因子 : 12.227(2022)
通讯单位 : 耶鲁大学

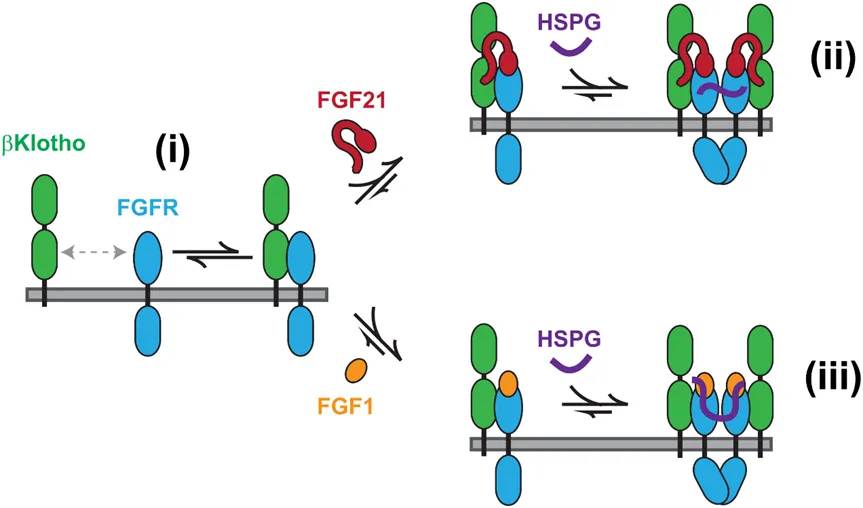
Figure 1. Mechanism of FGF21 and FGF1 signaling in cells with βKlotho.
成纤维细胞生长因子(FGF)家族的细胞因子在胚胎发育和多种人类疾病的发展过程中调节了各种重要的细胞过程。FGF家族的22个成员可分为三类:典型的FGFs,它以旁分泌的方式在细胞间发出信号;内分泌FGFs,它像素一样调节各种组织的代谢途径;以及细胞内FGFs,其与信号传导有关的生理作用仍不清楚。在典型的FGF信号传导中,配体和受体之间相对较弱的亲和力可以通过利用硫酸乙酰肝素(HSPGs)来弥补,HSPGs既是FGF的核心受体,又可以促进FGF受体(FGFR)分子的二聚化以激活下游信号传导。由于HSPGs广泛存在于细胞膜和细胞外基质上,因此典型的FGFs在分泌时不能自由扩散,这种有限的扩散特性对典型的FGFs调节高度协调的组织发育过程非常重要。与典型的FGFs不同,内分泌FGFs需要较高的扩散特性,以便它们能够运输至远处的组织结构之中,从而调节代谢信号。为此,内分泌FGFs已经失去了与HSPGs的亲和力,而获得了与αKlotho或βKlotho紧密结合的能力。然而,不太清楚的是,当肝素与FGFRs的结合是FGF信号传导的一个重要组成部分时,内分泌FGF信号传导是否能够完全不依赖于肝素;也不清楚FGF19、FGF21和FGF23如何刺激Klotho-FGFR复合物的二聚化和激活,以及肝素是否在内分泌FGF刺激细胞信号转导中起不可或缺的作用。在这篇文章中,作者提出了FGF21和FGF1信号传导复合物的形成机制(Figure 1)。其中,内分泌FGF信号传导不仅与典型FGF信号传导共同依赖HSPG,这是受体二聚化所必需的,而且肝素还可能通过配体诱导的受体内吞作用下调βKlotho来调节FGF21的信号传导。
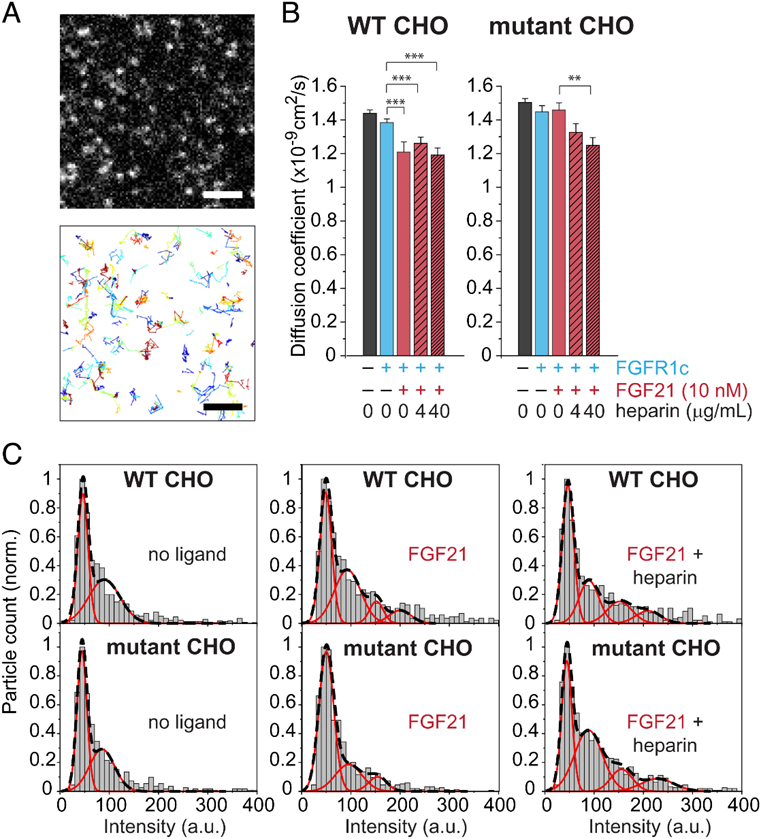
Figure 2. Single-molecule imaging of HaloTag-βKlotho.
作者利用全内反射荧光显微镜(TIRFM)进行单分子荧光成像,分析细胞同一区域内单个HaloTag-βKlotho颗粒的轨迹(Figure 2A)。并通过计算轨迹的均方位移(MSD)的扩散系数来量化βKlotho在细胞表面的横向流动性。在WT CHO细胞中,FGF21和FGFR1c的共同表达显著减少了HaloTag-βKlotho的扩散系数(Figure 2B),继续加入不同浓度的肝素则不会继续造成扩散系数的减少。与此相对,在缺乏HSPG的突变体CHO细胞中,FGF21和FGFR1c的表达并没有降低HaloTag-βKlotho的扩散系数,继续加入不同浓度的肝素则降低了HaloTag-βKlotho的扩散系数(Figure 2B)。分析HaloTag-βKlotho的颗粒强度分布也获得了相同的结果(Figure 2C),这些结果表明,FGF21以肝素依赖的方式促进βKlotho分子与FGFR1c的结合。
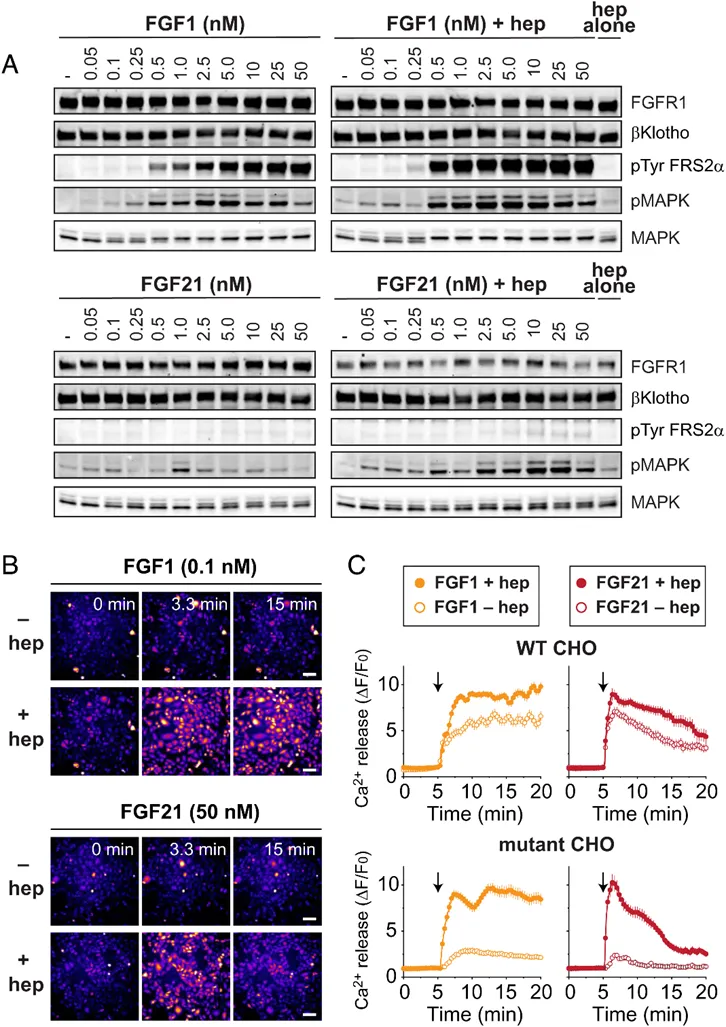
Figure 3. FGF21-induced stimulation of cell signaling requires heparin.
接下来作者研究了FGF21信号传导是否需要肝素。在突变体CHO细胞中,肝素存在条件下,FGF1和FGF21均能强有力的诱导MAPK的激活(Figure 3A)。但在不存在肝素的情况下,FGF21并不能诱导MAPK的激活,相对而言FGF1对肝素的依赖性较低,这可能是由于FGF1能够结合内源性硫酸软骨素,进而诱导了下游信号通路的激活(Figure 3A)。作者进一步研究了肝素对Ca2+信号的影响,其中Ca2+是由FGFR直接介导的。在稳定表达FGFR1c和βKlotho的WT CHO细胞中,FGF1和FGF21介导的Ca2+释放仅被肝素轻微增加(Figure 3B和C)。在突变体CHO细胞中,加入肝素造成了Ca2+大量释放(Figure 3B和C)。这些结果表明,肝素对FGF21激活的不同信号通路至关重要。

Figure 4. FGF1 induces clustering of βKlotho through FGFR1c–βKlotho interactions.
在验证肝素对FGF21信号传导作用的过程中,作者同时研究了FGF1与βKlotho的相互作用。结果显示,在突变体CHO细胞中,FGF1和肝素能够显著降低HaloTag-βKlotho的扩散系数(Figure 4A),以及改变HaloTag-βKlotho颗粒强度分布(Figure 4E)。当βKlotho受体结合臂被删除后,FGF1并不能降低HaloTag-βKlotho的扩散系数(Figure 4B),并且FGF1下游的信号激活也受到了影响,这些结果表明,FGF1通过与FGFR1c-βKlotho相互作用诱导βKlotho的聚集。
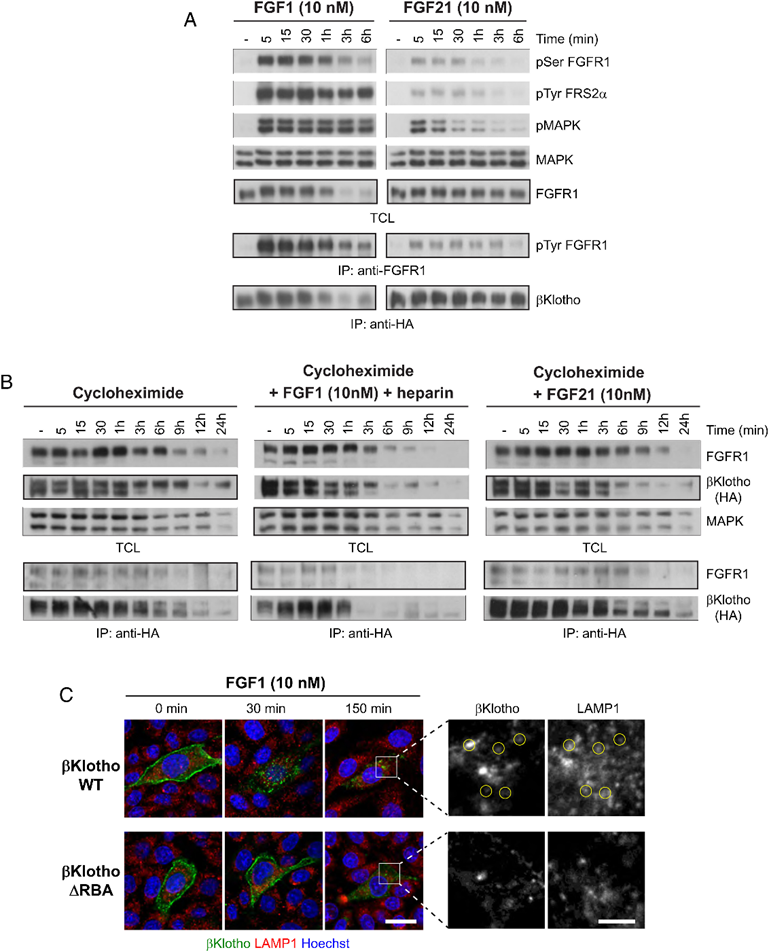
Figure 5. FGF1 promotes degradative trafficking of βKlotho.
已经证明了FGF1能够诱导βKlotho的聚集,作者继续验证了βKlotho是否能被FGF1刺激的内吞作用和随后FGFR1c的降解所下调。结果显示,在FGF1存在条件下,FGFR1c和βKlotho下调较为迅速。相反,在用FGF21刺激的细胞中,FGFR1c和βKlotho的水平没有显著变化(Figure 5A和5B)。在信号传导方面,FGF1诱导的FGFR1c及其下游信号分子的激活比FGF21强得多(Figure 5A和5B)。这些结果表明,FGFR1c和βKlotho水平的下调取决于FGFR1c激活的强度。最后,作者通过共聚焦显微镜检查了HaloTag-βKlotho的亚细胞定位,以确定FGF1对βKlotho的下调是否是由于降解性贩运。如Figure 5C所示,最初位于质膜的HaloTag-βKlotho被迅速内化,并在刺激后30分钟内出现许多细胞内斑点。再过120分钟后,可以看到HaloTag-βKlotho斑点与LAMP1共同定位,表明了降解性贩运。总结:肝素是在细胞膜上形成FGF21-βKlotho-FGFR1c复合物的必要条件,而且肝素或HSPG与FGFR1c的结合对于FGF21最佳地刺激FGFR1c的激活、丝裂原激活蛋白激酶反应和细胞内Ca2+的释放至关重要;FGF1结合刺激βKlotho和FGFR1c在细胞膜上的组装,导致βKlotho的内吞和降解。由于肝素或HSPG对于FGF21信号传导和促进FGFR1c二聚化,对βKlotho的细胞稳定性至关重要。
原文链接:
https://www.pnas.org/doi/full/10.1073/pnas.2219128120#sec-1
作者:汪浩
审核:李全才,吕友晶
编辑:邵萌
如有侵权,请联系删除