邮箱地址
前沿资讯
发布时间:2024-03-18 14:01:54 作者:青岛海大海洋寡糖科技有限公司 来源:本站
文章题目:MYC-driven synthesis of Siglec ligands is a glycoimmune checkpoint
发表期刊 :PNAS
影响因子 : 12.227(2022)
通讯单位 : 斯坦福大学

MYC是人类癌症中最常见的失调癌基因之一,其过表达与癌症患者的预后不良有关。Siglecs(sialic acid-binding immunoglobulin-like lectins)是一类免疫调节受体,在14个人源Siglecs中,有9个具有基于酪氨酸的免疫受体抑制基序(ITIMs),这些免疫抑制性Siglecs能够抑制免疫细胞的活化,帮助肿瘤细胞免疫逃逸。
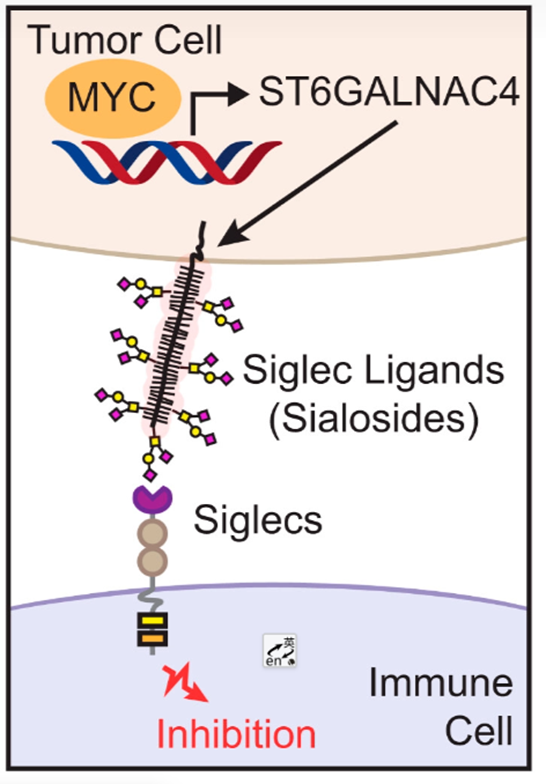
Figure 1. Model for MYC-driven display of disialyl-T and regulation of the immune response via Siglec engagement.
在这篇文章中,Bertozzi课题组研究发现MYC参与调节肿瘤细胞表面的糖基化,并在肿瘤细胞表面高表达disialyl-T(Neu5Acα2–3Galβ1–3[Neu5Acα2–6]GalNAc)糖链,该糖链能够做为糖免疫检查点与免疫细胞上的特异性Siglec受体结合,抑制机体的抗肿瘤免疫反应,从而促进体内肿瘤生长。首先,作者发现MYC的表达能够显著影响细胞表面的唾液酸的含量(Figure 2A-C)。该基因通过调节唾液酸转移酶St6galnac4的表达(Figure 2F-J),对O糖链,特别是disialyl-T的表达至关重要(Figure 2D,E)。
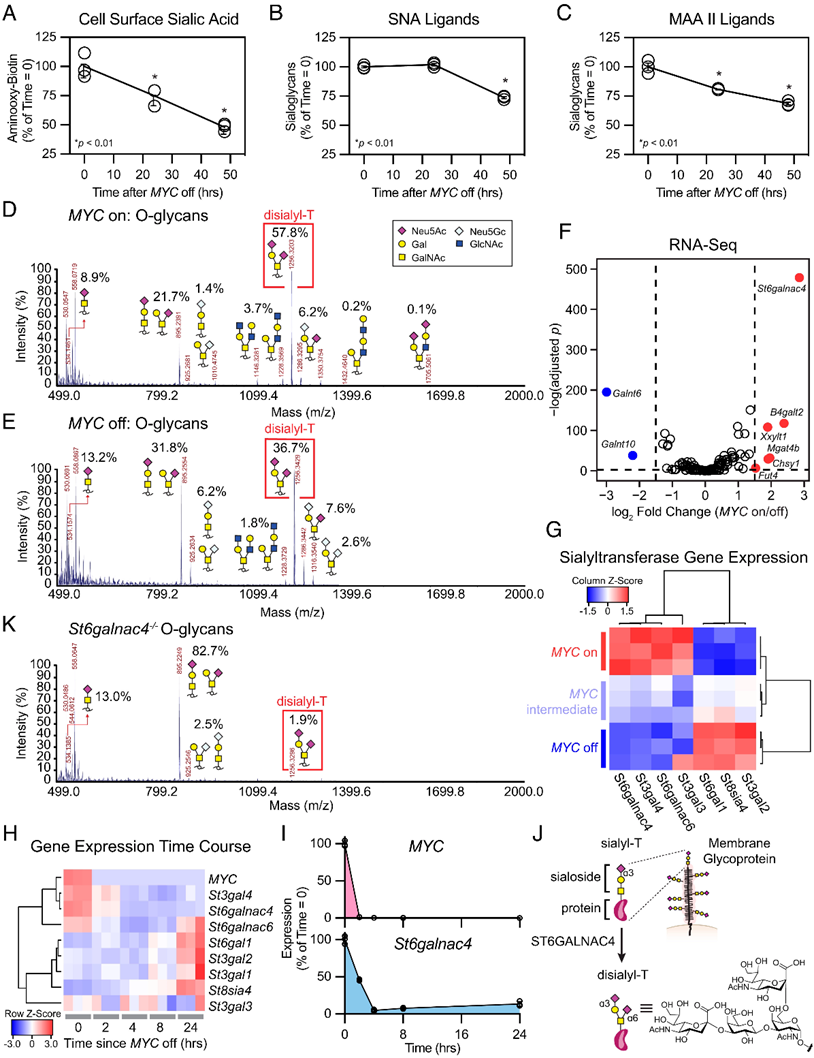
Figure 2. MYC regulated St6galnac4 promotes display of the glycan disialyl-T.
作者进一步研究发现MYC以及调节的St6galnac4能够介导细胞膜表面Siglecs配体的表达(Figure 3A-F),实现肿瘤细胞对BMDM细胞(Bone marrow-derived macrophages)的免疫逃逸(Figure 3G-K),调节BMDM细胞的细胞表型(Figure 3L),从而帮助肿瘤细胞实现免疫逃逸。
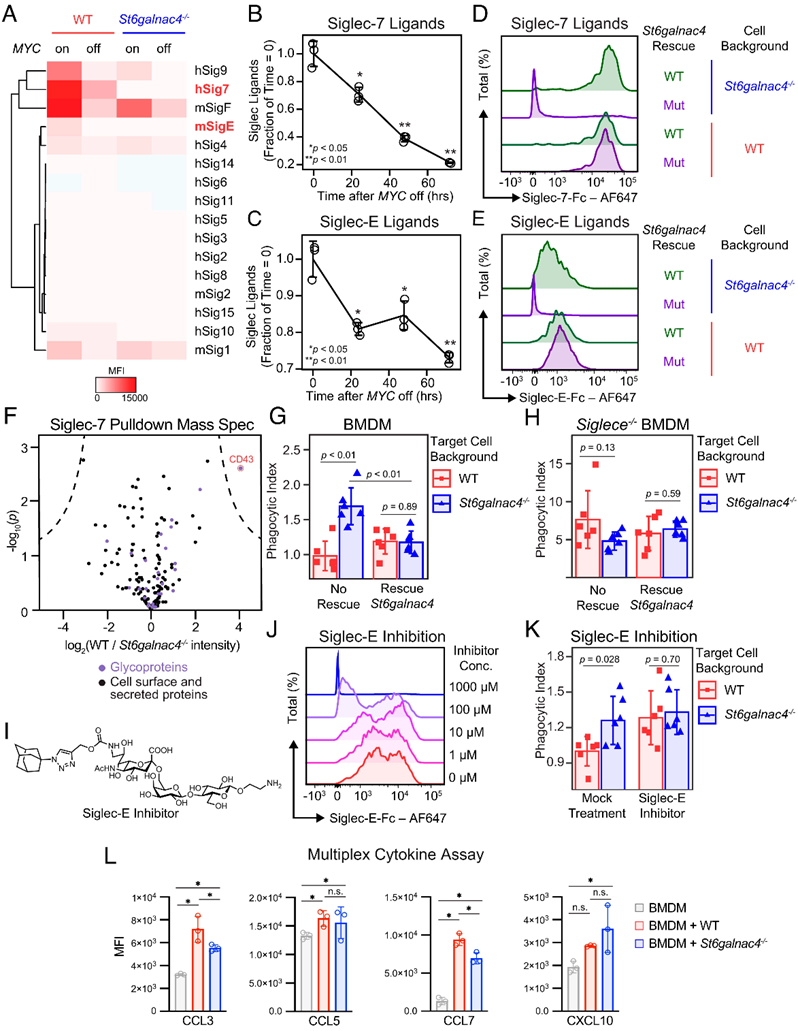
Figure 3. St6galnac4synthesizes Siglec-E/-7 ligands.
作者继续研究了St6galnac4和disialyl-T是否能够在体内促进肿瘤的生长。研究发现,St6galnac4敲除的T-ALL细胞小鼠体内的生长出现抑制(Figure 4A和AB),并且相关免疫细胞亚群也出现不同(Figure 4C和4D)。在Siglec-E敲除的小鼠和野生型小鼠中注射T-ALL细胞,虽然肿瘤细胞在两种小鼠中均形成了结节,但是只在Siglec-E敲除的小鼠中,观察到了肿瘤的消退(Figure 4E-G)。
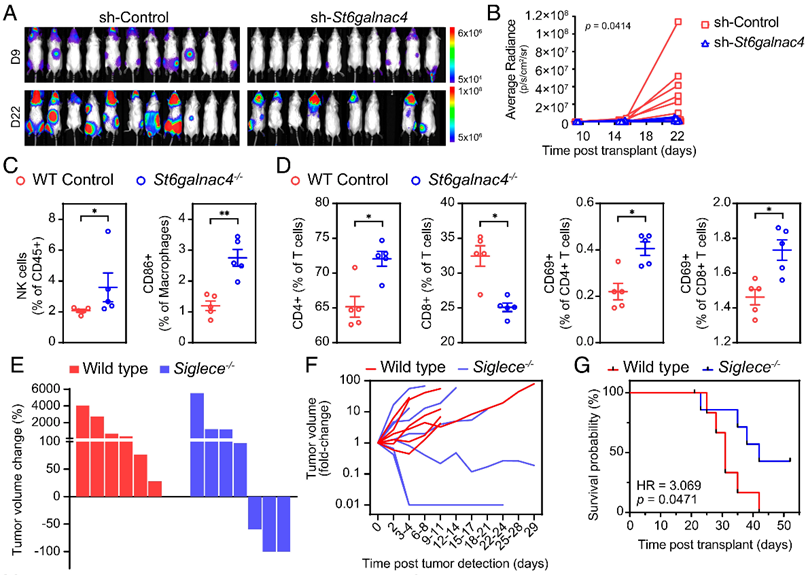
Figure 4. St6galnac4 promotes tumor growth in vivo.
最后,作者评价了将MYC和St6galnac4能否预测预测人类白血病和淋巴瘤的不良预后。研究发现,肿瘤患者T-ALL细胞中MYC和St6galnac4的表达升高(Figure 5A),St6galnac4的敲除(Figure 5B)以及抑制MYC(Figure 5C和5D)显著减少了人模型T-ALL细胞表面的Siglecs配体,于此同时,St6galnac4的敲除也增强了人源巨噬细胞对肿瘤细胞的吞噬作用。为了研究MYC是否在人类造血肿瘤中更普遍地调节St6galnac4和Siglec-7配体的产生,作者查阅癌症细胞系百科全书(CCLE)中包含的所有造血肿瘤的基因表达数据。发现MYC和St6galnac4表达之间存在正相关(Figure 5H),并且St6galnac4的高表达,在所有的唾液酸转移酶中,能够更为准确的预测弥漫性大B细胞淋巴瘤(DLBCL)、慢性淋巴细胞淋巴瘤(CLL)和Burkitt淋巴瘤(BL)等淋巴癌患者的预后不良(Figure 5I)。通过对癌症基因组图谱(TCGA)数据进行泛癌症生存分析,测试了MYC和St6galnac4在人类患者中共同过表达的临床后果。在所有癌症中,MYC和St6galnac4的高表达与生存率下降有关(Figure 5M)。除此之外, MYC高表达和St6galnac4高表达与免疫状态有关。MYC高表达和St6galnac4高表达的肿瘤中免疫细胞浸润明显少于缺乏这一特征的肿瘤(Figure 5N)。这说明,MYC和St6galnac4的高表达形成了一个恶性糖基化的特征。除此之外,对St6galnac4进行药物抑制以阻断Siglec配体的生物合成可能是对MYC活性升高的癌症的有效免疫治疗策略(Figure 5O)。
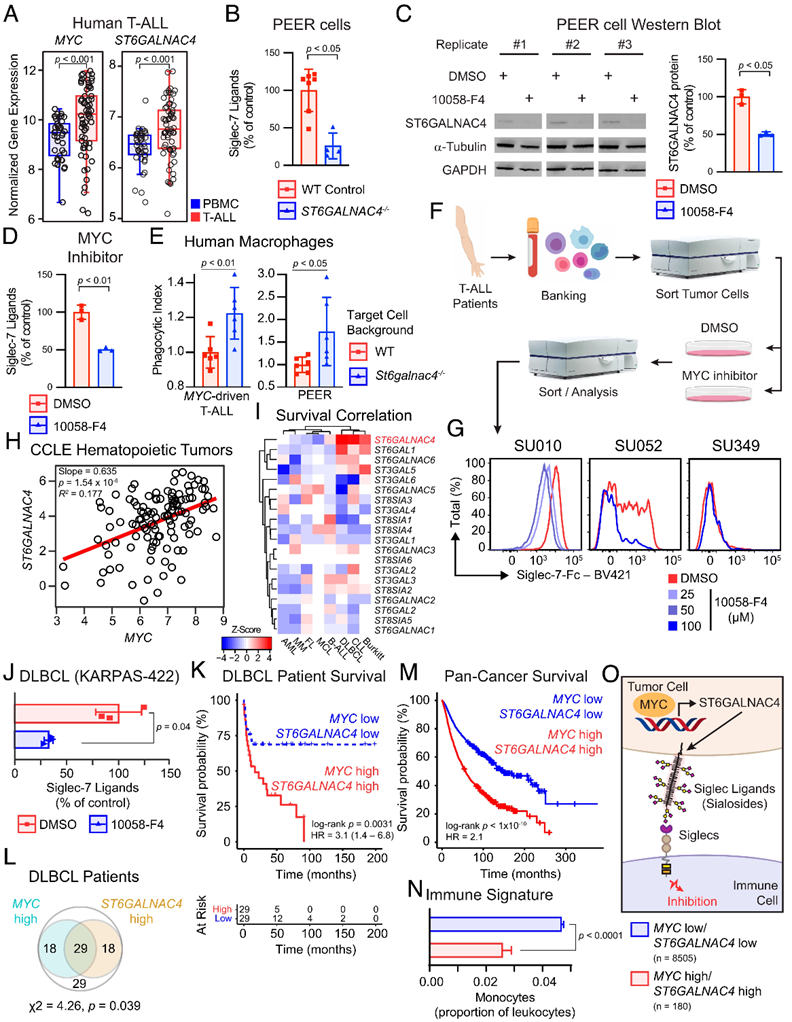
Figure 5. MYC promotes Siglec-7 ligand display on human cancer.
总结:
MYC能够通过调节St6galnac4等唾液酸转移酶的合成,控制癌细胞表面的糖基化,促进Siglec配体-特别是disialyl-T糖链的表达,从而促进了免疫逃逸。MYC和St6galnac4的联合高表达可识别出高危癌症患者,disialyl-T合成酶St6galnac4是小分子介导的免疫疗法的潜在酶靶。与此同时,由于disialyl-T丰度与MYC和St6galnac4高表达密切相关,因此,disialyl-T是基于抗体的检查点阻断的候选靶标。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2215376120
作者:汪浩
审核:李全才,吕友晶
编辑:邵萌
如有侵权,请联系删除