邮箱地址
前沿资讯
发布时间:2024-04-01 08:56:26 作者:青岛海大海洋寡糖科技有限公司 来源:本站
文章题目:Using heparan sulfate octadecasaccharide (18-mer) as a multi-target agent to protect against sepsis
发表期刊:PNAS
影响因子:12.779(2022)
通讯单位:University of North Carolina, Chapel Hill

今天介绍的文献是美国北卡大学教堂山分校药学院刘健教授课题组今年1月17号在PNAS杂志在线发表的关于硫酸乙酰肝素十八糖通过多靶点机制治疗脓毒症的工作。刘健教授课题组长期致力于研究硫酸乙酰肝素(Heparan Sulfate, HS)、肝素(Heparin, HP)和硫酸软骨素(Chondroitin sulfate, CS)等糖胺聚糖类化合物,尤其是通过酶法和化学酶法合成结构明确且均一、生物安全度高和药效明确的HS和HP,并关注他们在保肝和抗炎等药物活性方面的开发潜力。刘健教授课题组在前二十年的工作中建立了非常系统的HS和HP的化学酶法合成方法1,并将合成规模从微克级别提高到了百克级别,大量获取结构明确且均一的HS类化合物,能够支撑他们研究HS活性单元上特定硫酸化结构对生物活性的影响,阐明具体的构效关系。在之前的研究中,刘健教授课题组通过系统的化学酶法合成了大量的非抗凝HS寡糖6-mer、12-mer、18-mer,并评价了他们对临床上常见的对乙酰氨基酚(Acetaminophen/Paracetamol, APAP)过量服用导致的急性肝损伤相关的抗炎活性,具体的机制可概括为18-mer靶向结合并抑制HMGB1/RAGE轴,发挥抗炎保肝活性,这一过程与细胞表面HSPG家族中的Syndecan-1的HS糖链结合HMGB1的天然过程相近。18-mer不具备抗凝活性(无3-O-Sulation修饰),不会导致出血等副作用,同时18-mer因其多艾杜糖醛酸砌块和硫酸化修饰,不会被乙酰肝素酶(Heparanase)降解,具有良好的生物安全性和稳定性2。在前面研究的基础之上,刘健教授课题组进一步探究了HS寡糖18-mer的抗脓毒症活性。
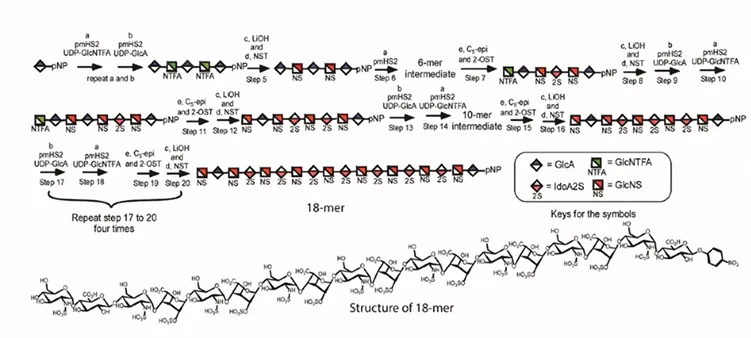
图1. HS寡糖18-mer的化学酶法合成
脓毒症(Sepsis)是由病原微生物感染导致的全身性炎症反应,全球每年有近5000万例脓毒症患者,病情凶险,病死率高,在ICU病房,已成为除心肌梗死等心脏病之外患者死亡的主要原因,尤其是新冠疫情期间,脓毒症是新冠患者死亡的重要原因。在脓毒症发生期间,有两种重要的带正电荷的蛋白参与了病理过程,分别是组蛋白H3(Histones H3, H3)和高迁移率族蛋白B1(High Mobility Group Box 1, HMGB1)。H3 通过与细胞膜中的磷脂-磷酸二酯相互作用直接诱导内皮细胞死亡,还可通过 Toll 样受体 (TLR) 信号通路间接放大炎症,导致器官损伤。HMGB1通过细胞内递送内毒素(脂多糖,LPS)导致细胞死亡,从而增加脓毒症小鼠的细胞损伤,HMGB1 递送 LPS 需要晚期糖基化终产物的受体(the Receptor of Advanced Glycation End products, RAGE)。
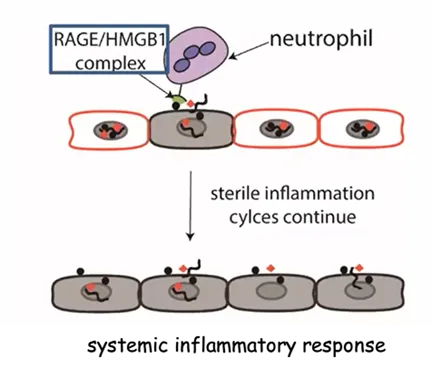
图2. HMGB1/RAGE介导脓毒症患者全身性炎症恶性循环
结合刘健教授课题组之前的研究,他们认为带负电荷的HS寡糖18-mer或许可以抑制H3和HMGB1,具有治疗脓毒症的药物开发潜力,同时因为有相对大量的化合物储备,可以支撑他们进行大量的动物实验。在进行抗脓毒症研究之前,他们先对化合物进行了抗Xa因子和抗IIa因子测定,证实用于实验的化合物不具备抗凝活性,生物安全性高。研究人员建立了盲肠结扎穿孔 (cecal ligation and puncture, CLP) 损伤诱导的脓毒症小鼠,并给予他们18-mer治疗(20 mg/kg)。实验数据表明,18-mer处理降低了小鼠H3和HMGB1的血浆浓度,并且降低了炎症因子(IL-6)、趋化因子(MCP-1)等的水平,证实18-mer确实可以减轻脓毒症小鼠的炎症反应,但该化合物并没有显著减少小鼠腹腔的细菌数量。
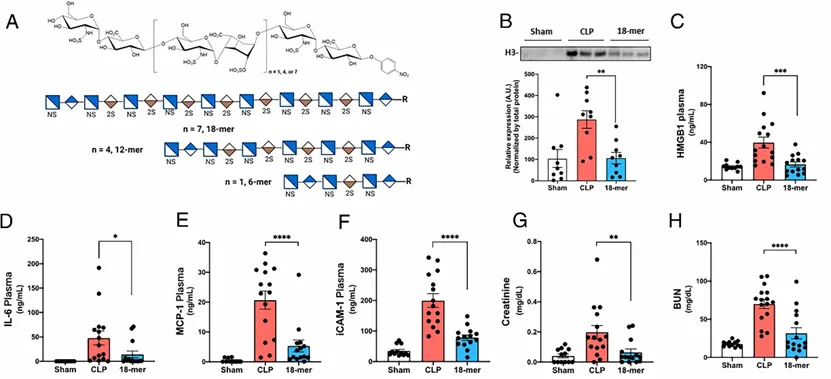
图3. 实验所用HS寡糖结构(A)及18-mer治疗CLP诱导脓毒症小鼠实验数据
之后,研究人员使用人内皮细胞系EA.hy926研究了不同HS寡糖对H3细胞毒性的影响,实验结果显示,18-mer可明显提高细胞活力,减少H3的毒性,并呈剂量依赖,治疗效果优于12-mer,远超过6-mer。通过SPR实验证实18-mer与H3有最强的结合力(KD = 66 nM)。同时,18-mer以剂量依赖性方式在腹膜灌洗液和血浆中降低了HMGB1/LPS的浓度,由此可减轻脓毒症小鼠炎症反应。需要注意的是,与18-mer结构类似,但不具备硫酸化形式的18糖NAc 18-mer并不具备H3结合活性和抗脓毒症活性,因其可被乙酰肝素酶(Heparanase)降解,而18-mer的结构中具有多硫酸化修饰和多艾杜糖醛酸砌块,可抗乙酰肝素酶降解,更好的发挥治疗药效。
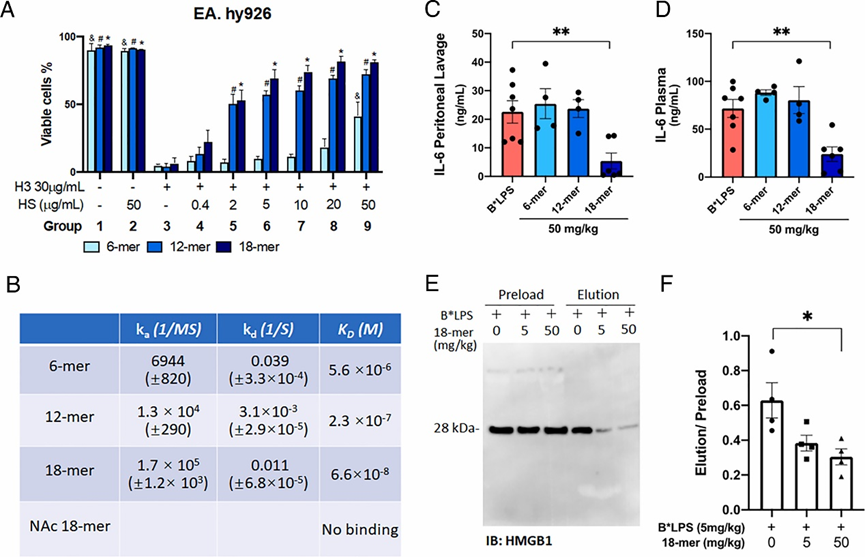
图4. 18-mer具有最佳的H3和HMGB1/LPS毒性抑制作用
然而,在进一步研究18-mer抑制HMGB1/LPS复合物形成机制的时候,研究人员发现与小鼠实验结果不同,体外的实验无法重现18-mer抑制复合物形成的结果,因此他们认为在体内有其他途径参与了该过程。于是,研究人员用生物素化的LPS对18-mer治疗小鼠的腹膜灌洗液和血浆进行pull down实验,并对发现的新蛋白条带进行蛋白组学分析,发现该蛋白为载脂蛋白A1(apoA1),且apoA1/LPS复合物的浓度随18-mer注射量增加而增加,而HMGB1/LPS浓度却呈下降趋势。
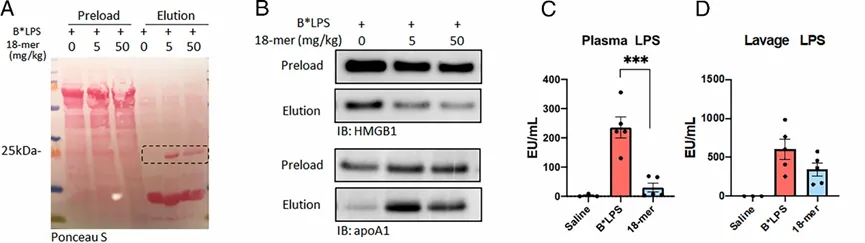
图5. apaA1蛋白参与了抑制HGMB1/LPS复合物形成的过程
研究人员认为可能是18-mer的治疗增加了apoA1的数量,apoA1在体外实验中也成功证实了可以破坏HMGB1/LPS复合物,而apoA1是高密度脂蛋白(high-density lipoprotein, HDL)的重要组成部分,HDL可以与LPS结合,迅速的从血液中清除,研究人员认为这之前存在必然的联系。在后面的实验中,研究人员证实了HDL以剂量依赖性地抑制了LPS对RAW 264.7细胞的毒性(促炎),并且他们发现18-mer可以与HDL结合,并将HDL中的apoA1释放出来。最后他们进行了小鼠实验,发现18-mer可以显著提高CLP诱导的脓毒症小鼠的生存率。

图6. 18-mer可将apoA1从HDL中释放出来从而发挥抗炎活性,提高CLP诱导的脓毒症小鼠生存率
最后,研究人员根据实验过程和结果,提出了HS寡糖18-mer在治疗脓毒症过程中可能的机制,共有四条途径:1)18-mer直接与组蛋白H3结合,减轻H3对细胞的毒性;2)18-mer与HDL结合,将apoA1从HDL中释放出来;3)由18-mer促释放的apaA1直接与LPS结合形成无毒的apoA1/LPS复合物,迅速被清除,避免其毒性;4)由18-mer促释放的apaA1可以破坏已经形成的HMGB1/LPS复合物,将HMGB1置换出来,进一步与LPS形成无毒复合物,被机体清除。

图7. 18-mer 在脓毒症中的作用机制
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2209528120
参考文献:
(1) Xu, Y.; Masuko, S.; Takieddin, M.; Xu, H.; Liu, R.; Jing, J.; Mousa, S. A.; Linhardt, R. J.; Liu, J. Chemoenzymatic Synthesis of Homogeneous Ultralow Molecular Weight Heparins. Science2011,334 (6055), 498–501.
(2) Arnold, K.; Xu, Y.; Sparkenbaugh, E. M.; Li, M.; Han, X.; Zhang, X.; Xia, K.; Piegore, M.; Zhang, F.; Zhang, X.; Henderson, M.; Pagadala, V.; Su, G.; Tan, L.; Park, P. W.; Stravitz, R. T.; Key, N. S.; Linhardt, R. J.; Pawlinski, R.; Xu, D.; Liu, J. Design of Anti-Inflammatory Heparan Sulfate to Protect against Acetaminophen-Induced Acute Liver Failure. Sci. Transl. Med. 2020,12 (535), eaav8075.
作者:王礼浩
审核:李全才,吕友晶
编辑:邵萌
如有侵权,请联系删除