邮箱地址
前沿资讯
发布时间:2024-06-10 09:05:19 作者:青岛海大海洋寡糖科技有限公司 来源:本站
文章题目:MUC1 Glycopeptide Vaccine Modified with a GalNAc Glycocluster Targets the Macrophage Galactose C-type Lectin on Dendritic Cells to Elicit an Improved Humoral Response
发表期刊: Journal of the American Chemical Society
影响因子:15.0
通讯单位:School of Biological and Chemical Sciences, University of Galway, University

Mucin-1(MUC1)是一种细胞表面的糖蛋白,在包括乳腺癌、肺癌、胰腺癌、结肠癌、前列腺癌和卵巢癌的一系列癌症细胞上高表达,并在癌症的发展中起着关键作用。MUC1的胞外结构域由数量不等的SAPDTRPAPGSTAPPAHGVT氨基酸序列串联重复组成,并且序列中的丝氨酸和苏氨酸残基可以被糖基化。肿瘤相关的MUC1的O-连接糖是截断的,支化程度较低,从而区分了肿瘤与正常细胞表面的MUC1,这也为开发特异性识别肿瘤细胞的MUC1疫苗提供了依据。巨噬细胞半乳糖型凝集素(Macrophage galactose-type lectin,MGL)是位于抗原呈递细胞(APC),特别是树突状细胞(DC)和巨噬细胞表面的一种内吞受体。MGL以钙依赖的方式与末端的α-或β-GalNAc残基结合,并能在碳水化合物识别域(CRD)外采用二级结合位点与糖蛋白或二糖结合。MGL在免疫调节中的作用并不完全清楚,但在某些情况下,Tn抗原与MGL的相互作用已被用于促进抗原处理在APCs上的呈递,以及提高免疫系统对肿瘤抗原的免疫力。基于以上背景,该研究构建了新型的三元候选疫苗,该疫苗由能够靶向MGL的三价TPE糖簇配体、P30 T细胞辅助表位和一个抗原性Tn修饰的MUC1糖肽组成。与对照疫苗相比,该疫苗三诱导了更高水平的抗体滴度,并且产生的抗体能够更有效的与MUC1-Tn阳性的T47D人类乳腺癌细胞相结合。
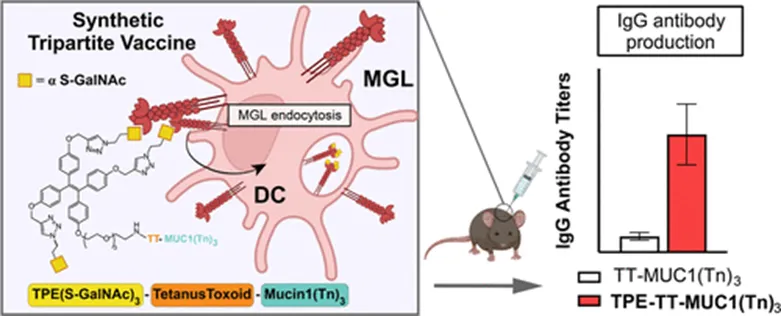
图1:TPE(S-GalNAc)3-Tetanus Toxold-Mucin1(Tn)3疫苗靶向APC并诱导高水平抗体示意图
具有靶向MGL作用的TPE糖簇配体是通过CuAAC反应,将α-S-GalNAc安装到TPE支架上,与此同时,未连接α-S-GalNAc的酚羟基通过酰胺化安装N-Fmoc-Asp-OtBu,并用于后续与MUC1相连(图2)。
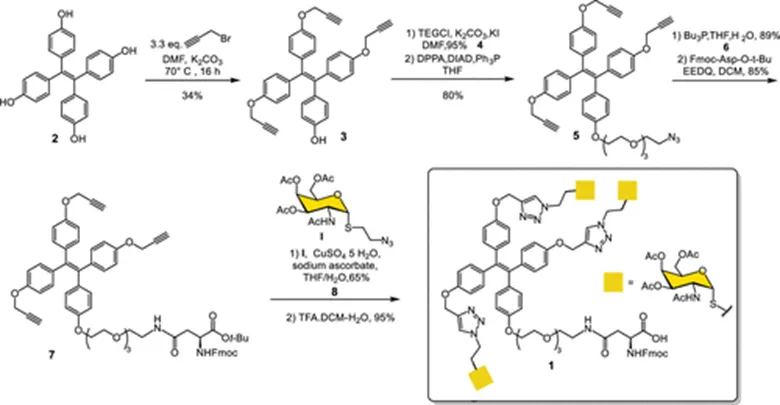
图2:TPE(S-GalNAc)3合成示意图
构建TPE糖簇配体后,该研究合成了一个小型肽库(图3,肽9-14)用于体外实验。这些肽的C端的氨基酸被生物素化的赖氨酸(KB)替换,用于将肽固定在涂有链霉菌素的ELISA板上,并用于流式细胞仪和荧光显微镜实验中的荧光标记。为了测试TPE糖簇配体对与MGL结合的影响,TPE糖簇配体被引入到肽12-14的N端。为了在体内实验中改善外源糖肽在MHC复合物上的呈现,并激活T细胞,作者还在携带Tn抗原的MUC1 TR(HGVTSAPDTRPAPGSTAPPA)糖肽的N端引入来自破伤风类毒素的T辅助表位P30(FNNFTVSFWLRVPKVSASHLE),从而获得糖肽疫苗15、16(图3)。

图3:糖肽9-16结构
接下来作者研究了TPE糖簇配体对多肽与MGL结合的影响。ELISA结果显示,含有TPE糖簇配体的多肽12-14与MGL结合能力要远远强于未修饰TPE糖簇配体的多肽9-11(图4),这证明TPE糖簇配体对多肽与MGL结合的重要性。继续研究发现,修饰有TPE糖簇配体的多肽12能够更有效的被BMDC细胞摄取和内化(图5A,B和图6),并且这种摄取是通过MGL介导的(图5A,C)。
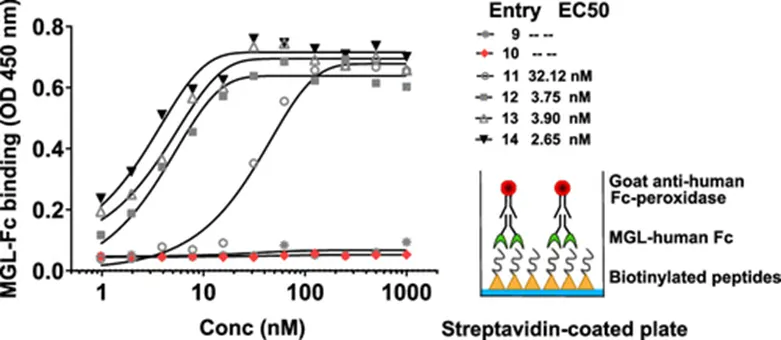
图4:Tn-MUC1糖肽与MGL结合的EC50值
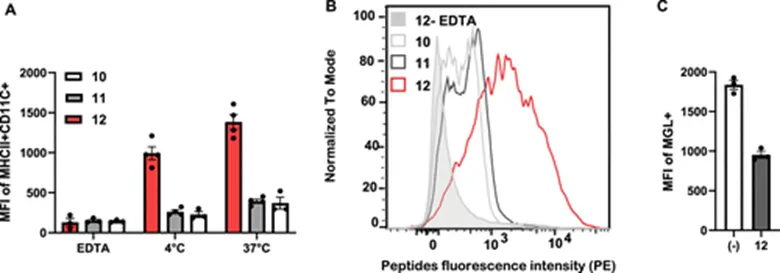
图5:(A)和(B)BMDC细胞对糖肽10-12的摄取ATPE(S-GalNAc);(C)糖肽12有效阻止了MGL与anti-MGL的结合
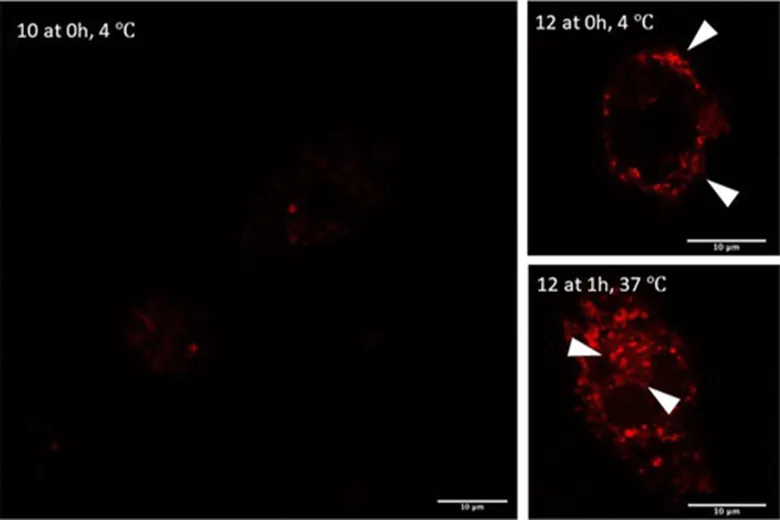
图6:荧光显微镜显示BMDC细胞对糖肽10、12的摄取
在证明了TPE糖簇配体在体外能够促进BMDC细胞对MUC1 TR糖肽的摄取之后,作者研究了糖肽疫苗15、16在小鼠体内对免疫系统的促进作用。研究发现,相比于疫苗15,糖肽疫苗16诱导了更加有效的体液免疫(图7A),并且疫苗16免疫后的血清能够更有效的结合T47D-MUC1肿瘤细胞(图8A,B)。
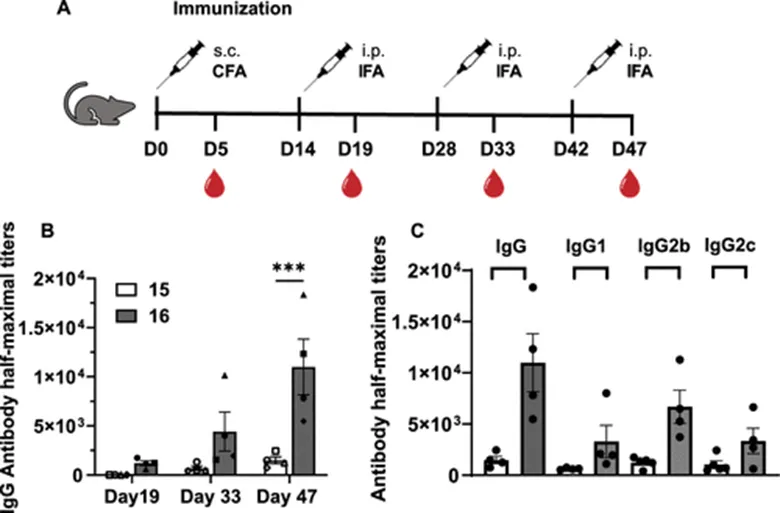
图7:(A)小鼠免疫策略示意图;(B)糖肽疫苗15、16诱导产生的IgG滴度;(C)IgG亚型分析
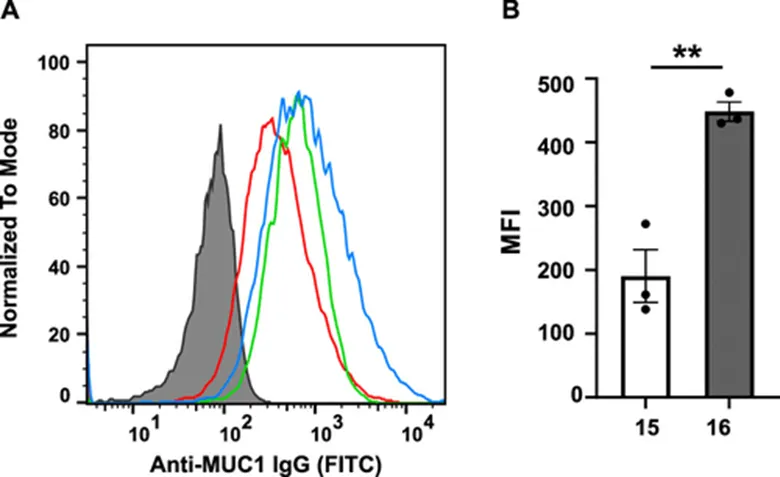
图8:糖肽疫苗免疫后血清与T47D-MUC1肿瘤细胞的结合情况
最后,作者通过糖芯片检测了免疫后血清对不同类型MUC1糖肽的识别能力,分析结果发现,糖肽疫苗16免疫后的血清能够更有效的识别肿瘤细胞表面高表达的MUC1糖肽,不识别正常组织细胞表面表达的MUC1复杂糖肽,这说明疫苗诱导产生的抗体对肿瘤细胞具有特异性(图9)。

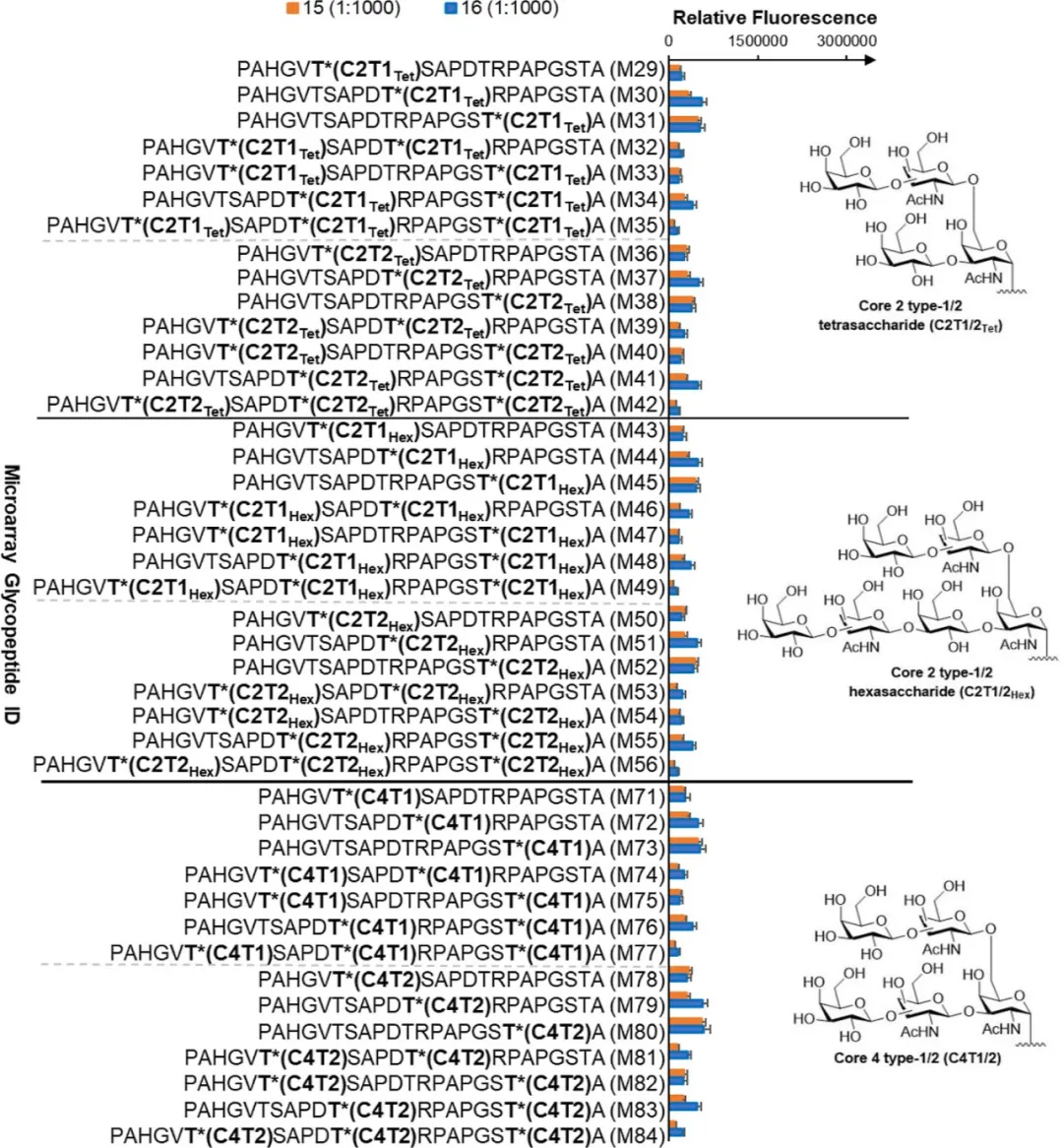
图9:免疫后血清对不同类型MUC1糖肽的识别能力
原文链接:https://doi.org/10.1021/jacs.2c12843
作者:汪浩
审核:李全才
编辑:邵萌
如有侵权,请联系删除