邮箱地址
前沿资讯
发布时间:2023-08-28 15:12:08 作者:青岛海大海洋寡糖科技有限公司 来源:本站
本篇基于《Targeting polysaccharides such as chitosan, cellulose, alginate and starch for designing hemostatic dressings》[1]进行写作。
止血敷料(hemostatic dressings,HDs)作用于创伤表面与人体组织直接接触,可以有效阻断病人的持续出血。根据不同的标准,可将HDs进行分类(图1)。
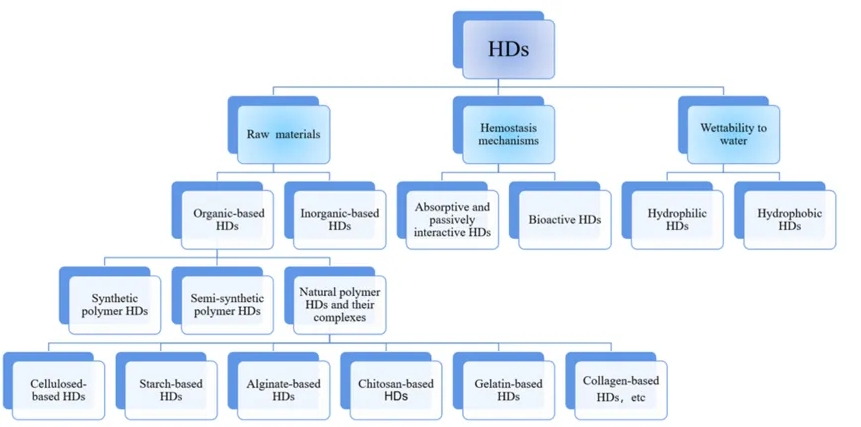
图1 按不同标准对HDs进行分类[1]

图2 多糖和止血机制及其相应作用方式概述[1]
01 混凝机理
人体内的凝血级联反应引发的止血可分为以血小板栓形成为结束的“一期止血”和以纤维蛋白凝块形成为结束的“二期止血”。人体自身的血液凝结速度相对较慢,因此特别是在大量出血的情况下,使用HDs是非常有必要的。根据是否依赖于凝血级联反应,HDs的止血机制可分为两类。一种是通过调节凝血级联反应(如聚集效应和电荷刺激)来加速血液凝固,另一种是通过物理粘合和封闭来实现创面的快速止血。在实际应用中,常常是几种止血机制同时起作用。
1.1浓缩效应
浓缩效应是材料实现止血的普遍方式。红细胞表面呈电负性。在带正电的阳离子的吸引下,它们会在出血部位周围浓缩,封闭伤口,然后控制出血。这体现的是材料表面和血细胞之间的相互作用。
1.2电荷效应
在内源性激活途径中,FXII(表面因子,也称为Hageman因子)可由带负电荷的胶原等通过接触激活而引发FXIIa。这体现了材料表面与凝血因子之间的相互作用。许多研究结果表明,具有表面电负性的材料(如沸石、二氧化硅、二维无机纳米片)可以有效地缩短活化部分凝血活酶时间(APTT)。
1.3物理止血(机械封闭止血)
具有很强的粘附性的HDs(又称止血密封剂),通过对出血部位的快速粘合和封闭,能够在短时间内止血,其作用依赖于准确的输送能力、损伤的大小、失血率以及组织粘连的速度,与凝血级联无关。
02 多糖类HDs的设计策略
纤维素、淀粉、壳聚糖、透明质酸和海藻酸钠等多糖具有丰富的来源,且其生物相容性好、生物活性多样化,在医用材料开发应用方面具有很广阔的前景。不同的多糖其理化性质不尽相同,在HDs的设计策略上也有所不同。
2.1HDs的组件化设计
2.1.1 多糖/多糖复合物
可根据多糖特性进行设计,如壳聚糖本身具有抗菌和止血作用;海藻酸盐可以通过简单的钙离子交联来制备水凝胶;明胶具有温度响应特性等。此外,多糖复合物也可以起到良好的止血效果,如利用细菌纤维素、壳聚糖和胶原制备具有生物可降解性和抗菌特性的纳米复合止血海绵[2]。
2.1.2 多糖/合成聚合物复合
聚乙二醇氰基丙烯酸酯(α-氰基丙烯酸酯)、聚乙二醇酯、聚氨酯、聚酯等是常用的合成聚合物类止血材料。一般情况下,它们遇到血液后会形成很强的胶体,通过阻塞血管来起到止血作用。
利用特定的靶点可开发用于静脉注射的合成聚合物止血剂,如PolySTAT,其在能够在血液中无害循环,识别血管损伤部位进行止血,将PolySTAT集成到非织造壳聚糖纱布上,可增加材料的耐压效果[3-4]。
多糖还可以通过整合具有识别功能的多肽来设计和制备血小板替代物。如Gao等人通过将透明质酸(HA)与肽融合,构建了一种静脉注射止血材料HAPPI,其可以作为血小板的替代品,通过提高血栓形成率和增加血栓强度来提高止血率[5]。
2.1.3 多糖/无机材料复合物
硅酸盐(如沸石、高岭石、蒙脱石和生物活性玻璃)具有浓集效应和负电荷刺激作用,可用于设计HDs。但单一的无机材料HDs,如基于沸石的HDs会导致远端血栓形成、热效应和难以清除导致的长期毒性。所以构建多糖-无机复合材料是解决安全风险和提高止血效果的双赢方式。如用硅藻二氧化硅代替合成二氧化硅,并将壳聚糖包覆在硅藻硅表面,最终制备出具有优异止血性能和生物相容性的多糖-无机复合止血剂[6]。
2.1.4 多糖/金属材料复合物
以银、钙、镁、铜、锌、铁为代表的金属离子以及其纳米颗粒可提高HDs材料的止血性能、抗菌能力、机械性能、光热转化能力等。如用巯基琥珀酸改性壳聚糖,利用巯基固定纳米银,制备了一种具有快速止血作用和长期抗菌活性的多功能海绵[7]。
2.2HDs的结构设计
2.2.1 亲水性三维多孔支架的构建
液体摄取率越高、液体摄取速度越快的HDs止血能力越强。亲水性材料具有良好的润湿性,三维多孔结构具有良好的浓缩作用,将这二者组合是HDs设计的一种思路。多糖含有丰富的亲水基团,可赋予材料良好的吸水率和保水能力,多糖类三维多孔支架可通过模板法、冷冻干燥、超临界二氧化碳干燥、3D打印等方法创建。此外,3D多孔支架(如经壳聚糖处理的XStatTM [8])还可以通过填塞效应对创面空隙进行填充,增加材料与组织的接触面积,阻止血液外流。
2.2.2 具有疏水作用的HDs的构建
利用疏水作用实现止血的方法有两种,即(1)在原多糖敷料上构建超疏水层;(2)将少量疏水尾巴嫁接到多糖分子链上。
2.2.2.1 引入疏水基团
将羟甲基壳聚糖与羟基咖啡酸修饰的壳聚糖结合,制备了一种具有良好生物相容性和生物降解性的无缝缝合伤口阻止粘合剂,具有良好的止血效果和抗菌功能[9]。但该方法存在一定的局限性:壳聚糖与血细胞膜之间因疏水作用而形成的血液凝块比较脆,封闭效果不够强,不能抵抗外力的破坏。
2.2.2.2 构建超疏水表面
通常可通过自上而下和自下而上的加工方法构建超疏水表面。超疏水表面HDs具有以下优点:①可以通过排斥血液来防止失血过多;②可以减少材料和细菌对伤口的粘附。如Yuk等人构建了一种由疏水油基质和由聚(丙烯酸)(PAA)-NHS酯和壳聚糖组成的生物粘附性微粒组成的糊剂,用于密封各种出血组织[10]。
2.2.3 动态湿式粘合止血策略
通过密封作用发挥止血功能的HDs通常称为止血密封剂(也称为组织粘合剂或生物粘合剂),可加工成海绵、水凝胶、粉末等各种形状,可在短时间内封闭破损伤口,快速止血。
2.2.3.1 儿茶酚诱导的粘连
如壳聚糖-儿茶酚海绵的原理是当其与血液接触时,壳聚糖-儿茶酚海绵会与血液中的蛋白质相互作用,形成屏障层,防止出血。改善因天然壳聚糖在中性条件下不能溶解导致的成膜能力有限,增加其止血效果[11]。
2.2.3.2 原位光致粘连
对于主动脉破裂和心脏穿透引起的失血,由于失血量大、出血速度快、特殊的动态湿组织环境,对止血药物的性能要求较高。要求止血剂具有快速的凝胶化能力、强而快速的湿性粘附性、适当的机械性能以承受血压以及周围组织的挤压或摩擦,以及良好的生物相容性。Ma等人制备了一种壳聚糖光响应型救援胶(LBA,光绷带),可在不添加任何引发剂或交联剂的前提下实现肝脏和心脏的止血,且壳聚糖还具有良好的抗菌效果,防止感染的发生[12]。
2.2.3.3 分子针粘连
即使在潮湿的环境中,多糖也可以作为分子缝线在底物之间实现强大的粘附力。Yang等人使用壳聚糖作为分子缝线,以pH为触发,通过拓扑分子水平的纠缠实现水凝胶和水凝胶之间的强粘合[13]。
2.2.3.4 NHS-酯介导的共价粘附
多糖可以作为载体携带具有更强止血特性的物质,N-琥珀酰亚胺酯(NHS-酯)可与组织中的胺基、血液蛋白发生反应和载体形成共价交联,封闭出血部位并提供牢固的组织附着,是一种良好的生物粘合剂。Boerman等人开发了一种涂有NHS-酯功能化聚(2-恶唑啉)(POx)的明胶贴剂,由于 POx 的结构多功能性,可以更早地调整其止血性能[14]。
2.2.3.5 可逆粘合
高粘合强度的HDs可更好的封闭出血部位,但是也对定期清创和更换材料造成一定阻碍,因此制备具有可逆和可控粘合能力的生物粘合剂很有必要。粘附性能可以由特定条件触发,例如金属离子、温度或特定化学试剂。Xu等人将具有热响应性的聚合物聚(N-异丙基丙烯酰胺) (pNIPAM)引入壳聚糖基水凝胶粘合剂系统 (壳聚糖-儿茶酚-pNIPAM 水凝胶) 以控制粘合强度[15]。
03 展望
基于多糖的HDs的开发还有许多瓶颈问题等待研究者们去完善和克服。相较于关注度更高的亲水性HDs,疏水性HDs的动物实验数据需进一步探究,止血机制也有待进一步研究。此外,HDs(亲水性或疏水性)与血液成分在细胞尺度和分子尺度上的相互作用机制也需要细化和完善,以便改性多糖赋予HDs更多可能性和巨大潜力。同时也需要关注HDs的安全性,补充其长期生物相容性的相关数据,关注其对机体产生的长期影响。除此之外,可利用多糖理化特性制备可生物降解的HDs,并赋予其除止血以外更多的功能,如加速伤口愈合,减少因失血引起的并发症和后遗症等。
参考文献
[1] Wang L., Hao F., Tian S., Dong H., Nie J., Ma G.(2022) Targeting polysaccharides such as chitosan, cellulose, alginate and starch for designing hemostatic dressings, Carbohydrate Polymers, Volume 291,2022,119574.
[2] Yuan, H., Chen, L., & Hong, F. F. (2020). A biodegradable antibacterial nanocomposite based on oxidized bacterial nanocellulose for rapid hemostasis and wound healing. ACS Applied Materials & Interfaces, 12(3), 3382–3392.
[3] Chan, L. W., Wang, X., Wei, H., Pozzo, L. D., White, N. J., & Pun, S. H. (2015). A synthetic fibrin cross-linking polymer for modulating clot properties and inducing hemostasis. Science Translational Medicine, 7(277), Article 277ra229.
[4] Chan, L. W., Kim, C. H., Wang, X., Pun, S. H., White, N. J., & Kim, T. H. (2016). PolySTAT-modified chitosan gauzes for improved hemostasis in externalhemorrhage. Acta Biomaterialia, 31, 178–185.
[5] Gao, Y., Sarode, A., Kokoroskos, N., Ukidve, A., Zhao, Z., Guo, S. Mitragotri, S., … (2020). A polymer-based systemic hemostatic agent. Science Advances, 6(31), Article eaba0588.
[6] Feng, C., Li, J., Wu, G. S., Mu, Y. Z., Kong, M., Jiang, C. Q. Chen, X. G., … (2016). Chitosan-coated diatom silica as hemostatic agent for hemorrhage control. ACSApplied Materials & Interfaces, 8(50), 34234–34243.
[7] Wu, Z., Zhou, W., Deng, W., Xu, C., Cai, Y., & Wang, X. (2020). Antibacterial andhemostatic thiol-modified chitosan-immobilized AgNPs composite sponges. ACS Applied Materials & Interfaces, 12(18), 20307–20320.
[8] Du, X., Wu, L., Yan, H., Jiang, Z., Li, S., Li, W. Zhu, M., … (2021). Microchannelled alkylated chitosan sponge to treat noncompressible hemorrhages and facilitate wound healing. Nature Communications, 12(1), 4733.
[9] Du, X., Liu, Y., Yan, H., Rafique, M., Li, S., Shan, X. Wang, L., … (2020). Anti-infective and pro-coagulant chitosan-based hydrogel tissue adhesive for sutureless wound closure. Biomacromolecules, 21(3), 1243–1253.
[10] Yuk, H., Varela, C. E., Nabzdyk, C. S., Mao, X., Padera, R. F., Roche, E. T., & Zhao, X. (2019). Dry double-sided tape for adhesion of wet tissues and devices. Nature, 575 (7781), 169–174.
[11] Kim, K., Ryu Ji, H., Koh, M.-Y., Yun Sung, P., Kim, S., Park Joseph, P. Lee, H., … (2021). Coagulopathy-independent, bioinspired hemostatic materials: A full research story from preclinical models to a human clinical trial. Science Advances, 7(13), Article eabc9992.
[12] Ma, Y., Yao, J., Liu, Q., Han, T., Zhao, J., Ma, X. Xu, F., …(2020). Liquid bandage harvests robust adhesive, hemostatic, and antibacterial performances as a first-aid tissue adhesive. Advanced Functional Materials, 30(39), Article 2001820.
[13] Yang, J., Bai, R., & Suo, Z. (2018). Topological adhesion of wet materials. Advanced Materials, 30(25), Article e1800671.
[14] Boerman, M. A., Roozen, E., Sanchez-Fernandez, M. J., Keereweer, A. R., Felix Lanao, R. P., Bender, J.Van Hest, J. C. M., … (2017). Next generation hemostatic materials based on NHS-ester functionalized poly(2-oxazoline)s. Biomacromolecules,18(8), 2529–2538.
[15] Xu, R., Ma, S., Wu, Y., Lee, H., Zhou, F., & Liu, W. (2019). Adaptive control inlubrication, adhesion, and hemostasis by chitosan-catechol-pNIPAM. Biomaterials Science, 7(9), 3599–3608.
作者:邵萌
审核:辛萌,吕友晶,李全才
编辑:邵萌