邮箱地址
前沿资讯
发布时间:2023-10-09 10:06:13 作者:青岛海大海洋寡糖科技有限公司 来源:本站
文章题目:Sialic acids on B cells are crucial for their survival and provide protection against apoptosis
发表期刊:PNAS
影响因子:11.205(2022)
通讯单位:University of Erlangen, Germany

唾液酸是广泛存在于细胞膜表面糖链末端的一类九碳糖衍生物,并在细胞信号传导、细胞迁移以及免疫调节等生命过程中发挥着重要作用。唾液酸聚糖是唾液酸结合免疫球蛋白样凝集素 (Siglecs) 的天然配体,其通过顺式或者反式相互作用参与抑制免疫细胞中的细胞信号传导,从而调节免疫反应;唾液酸聚糖能够被选择素识别,进而调节免疫细胞迁移;除此之外,唾液酸糖还能够通过结合液相蛋白因子H,调节补体系统。因此,机体正是依赖于唾液酸聚糖识别自身和非自身成分,在抵御外来病原体感染的同时保护自身组织细胞免受免疫系统攻击。
在之前的研究中,唾液酸已经被证明能够通过与B细胞表面的CD22以及Siglec-G进行顺式结合,从而抑制B细胞的激活,这一特性已经被应用于过敏反应的脱敏治疗。尽管唾液酸在免疫系统重要地位已经被广泛认同,但是人们对唾液酸在免疫细胞中功能知之甚少。在这篇文章中,作者通过敲除胞苷一磷酸唾液酸合酶 (CMAS),发现唾液酸能够有效抑制外在细胞凋亡途经对B细胞的清除作用。
为了研究唾液酸在B细胞表面的功能,作者首先分析了在B细胞特异性Cmas KO 小鼠中,唾液酸缺失对B细胞亚群的影响。在这些小鼠中,作者发现骨髓中的B细胞在分化过程中数量不断减少(图1 A-B),并且在脾脏中也几乎没有检测到任何 B 细胞(图1 C-D)。并且B细胞的缺失导致 B 细胞特异性 Cmas KO小鼠中所有类别的血清抗体缺失。
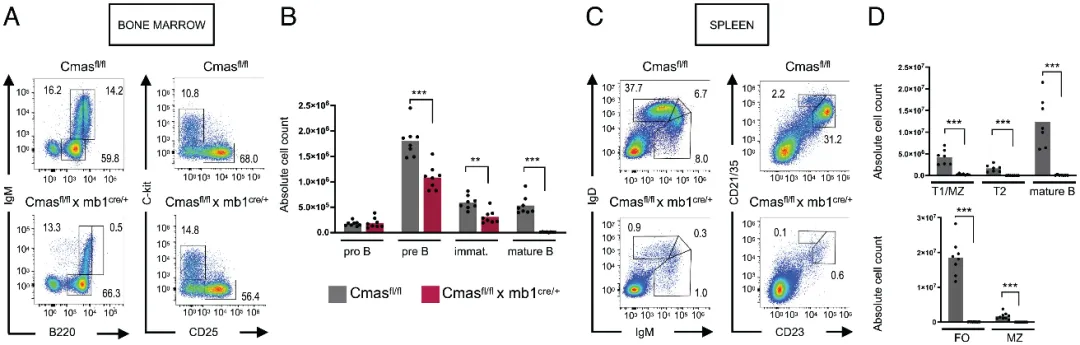
图1:Cmas KO小鼠中B细胞数量的变化。(A)和(B)骨髓中不同发育阶段B细胞数量的变化;(C)和(D)脾脏中不同发育阶段B细胞数量的变化。
作者继续通过流式细胞术进行凝集素染色,以确定B细胞特异性Cmas KO小鼠的不同B细胞群的唾液酸化损失程度。结果表明,随着Cmas KO小鼠B细胞的分化,细胞表面唾液酸化逐渐丧失(如图2 A)。来自 B 细胞特异性 CMAS KO小鼠骨髓的成熟B细胞丢失了所有α-2,6连接的唾液酸。除此之外,骨髓中的CMAS KO成熟B 细胞还失去了 α-2,3 连接的唾液酸(如图2 A)。在脾脏中,α-2,6连接的唾液酸和α-2,3 连接的唾液酸在Cmas KO小鼠的所有B细胞亚群中也几乎完全不存在(图2 B-D)。这些结果说明,Cmas KO小鼠的B细胞,随细胞表面唾液酸含量的降低,而逐渐被清除。
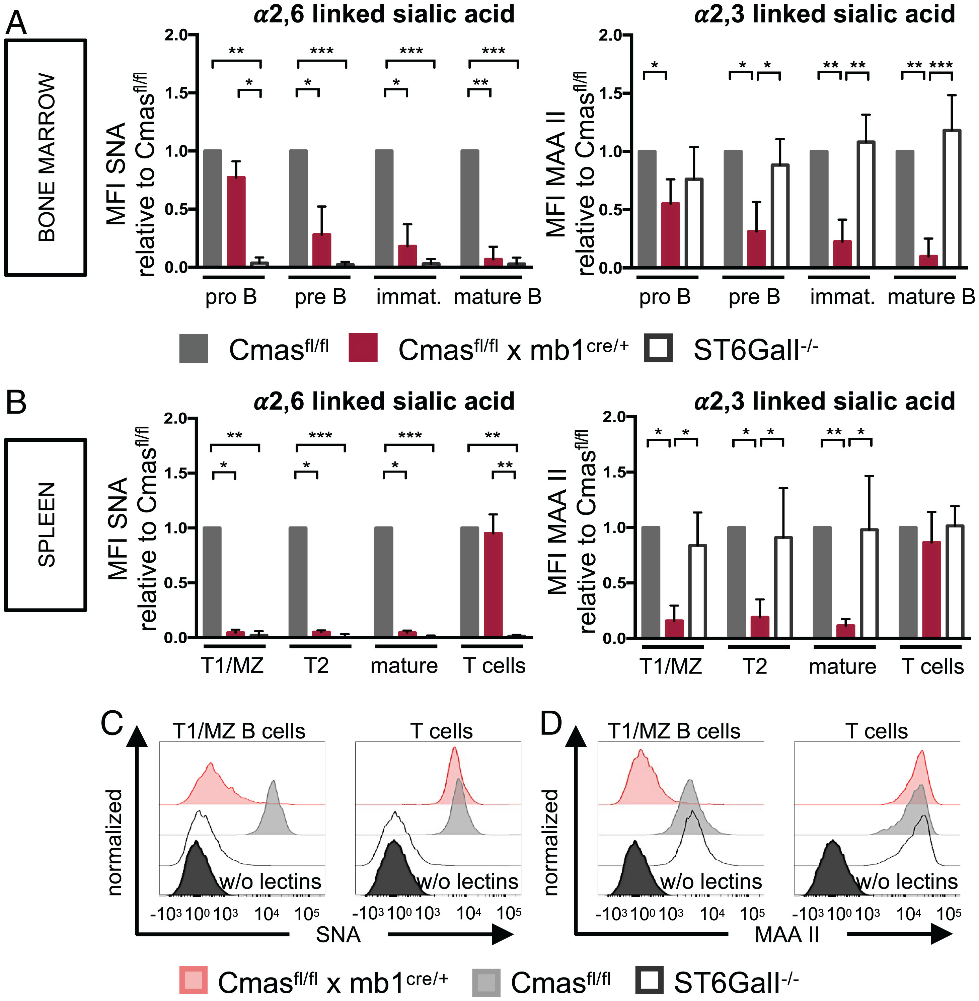
图2:Cmas缺乏导致B细胞表面唾液酸含量下降。(A)骨髓中不同发育阶段B细胞表面唾液酸含量;(B)脾脏中不同发育阶段B细胞表面唾液酸含量;(C)和(D)脾脏中B细胞和T细胞凝集素染色结果。
既然,Cmas KO小鼠做的B细胞在发育过程中出现了严重的B细胞缺陷,因此作者继续对产生这种B细胞缺陷的机制展开了研究。由于IL-7是B细胞存活和增殖的关键细胞因子,作者首先探究了IL-7在该B细胞缺失过程中的影响。分别从 Cmasfl/fl 和 Cmasfl/fl× mb1-cre(Cmas KO)小鼠的骨髓中分选出 pro-B 细胞,并分别在存在和不存在IL-7 的条件下培养这些分选的细胞。细胞计数发现直到第5天,在含有IL-7培养基中两种 pro-B 细胞的细胞分裂情况相似。但是,继续培养发现,第5天到第 8 天,Cmasfl/fl pro-B 细胞的数量进一步增加,而Cmasfl/fl × mb1-cre pro-B 细胞的数量没有进一步增加(图3 A)。检测细胞表面的唾液酸含量发现,第0天和第8天之间 Cmasfl/fl × mb1-cre pro-B 细胞表面唾液酸的含量不断减少,但是并未完全达到低水平(图3 B)。基于以上结果,作者推测pro-B细胞表面的唾液酸含量降至某个临界阈值以下,细胞数量就会停止增加。

图3:(A)Cmas KO小鼠的pro-B细胞在含IL-7培养基中表现出细胞分裂缺陷;(B)Cmas KO小鼠的pro-B细胞在含IL-7培养基中唾液酸含量逐渐减少。
作者继续研究了Cmas KO小鼠外周淋巴器官中 B 细胞严重减少的机制。由于 α-2,3 连接的唾液酸可以与补体因子 H 结合从而抑制补体活化,作者首先怀疑了补体的杀伤作用造成了Cmas KO小鼠的B细胞缺陷。为此,作者使用了Cmasfl/fl × mb1-cre × C3-/-杂交小鼠,该类小鼠缺乏中央补体因子C3,从而抑制补体途径的激活。如图四所示,Cmasfl/fl × mb1-cre × C3-/-杂交小鼠的骨髓和脾脏中大多数 B 细胞群数量得到了显著恢复,但其仍然低于正常小鼠的B细胞,这一结果说明Cmas KO小鼠的B细胞缺陷不能完全用补体攻击来解释。
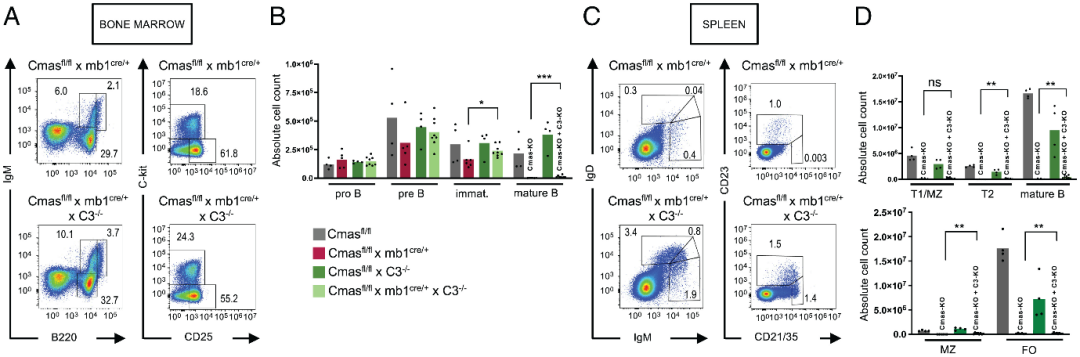
图4:补体因子C3缺乏不能逆转Cmas KO小鼠的B细胞缺陷。(A)和(B)骨髓中B细胞数量的变化;(C)和(D)脾脏中B细胞数量的变化。
作者探究了细胞凋亡是否是造成Cmas KO小鼠B细胞缺陷的原因。结果显示,高达25% Cmas KO小鼠成熟B细胞检测到了激活的Caspase-3(图5 A-D)。因此,作者推测B细胞凋亡水平的上调是B细胞缺陷的主要原因。为了验证这一猜想,作者探究了通过高表达Bcl-2来阻断内在的细胞凋亡途经能否逆转Cmas KO小鼠的B细胞缺陷,结果显示,过表达Bcl-2 转基因并没有完全逆转Cmas KO小鼠的B细胞缺陷(图5 E-F)。这说明,细胞凋亡与B细胞特异性Cmas KO小鼠中B细胞的缺陷有关,但内在的细胞凋亡途径不是主要机制。
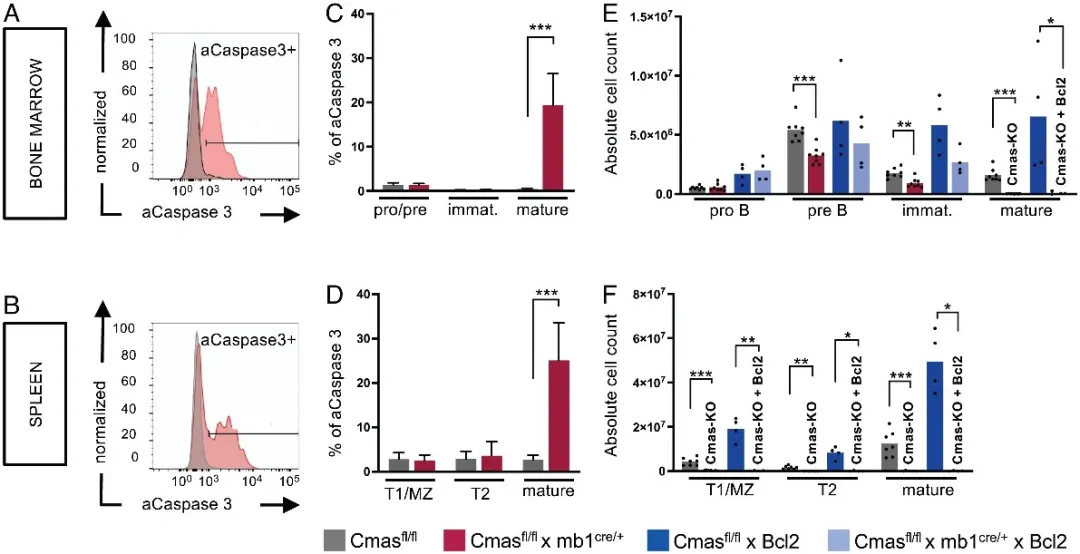
图5:(A-D)Cmas KO小鼠B细胞检测到了显著的细胞凋亡;(E)和(F)抑制内在凋亡途径不能完全逆转Cmas KO小鼠的B细胞缺陷。
为了继续研究外在凋亡过程对 B 细胞特异性 Cmas KO小鼠B细胞缺陷的影响,作者首先确定了Cmas KO小鼠B细胞Fas的表达水平。结果显示,发现成熟Cmas KO B细胞上的Fas表达上调(图6 A-B)。使用FasL处理Cmas KO和对照小鼠的B细胞,并通过细胞内染色发现,Cmas KO小鼠的B细胞观察到更高水平的被切割的Caspase-8。在机制探索的最后,作者将分选获得B细胞在体外培养,发现Cmas KO小鼠的B细胞凋亡与对照组没有区别,而培养总骨髓细胞的时候,Cmas KO小鼠的B细胞产生了更高程度的细胞凋亡(图7 C-D)
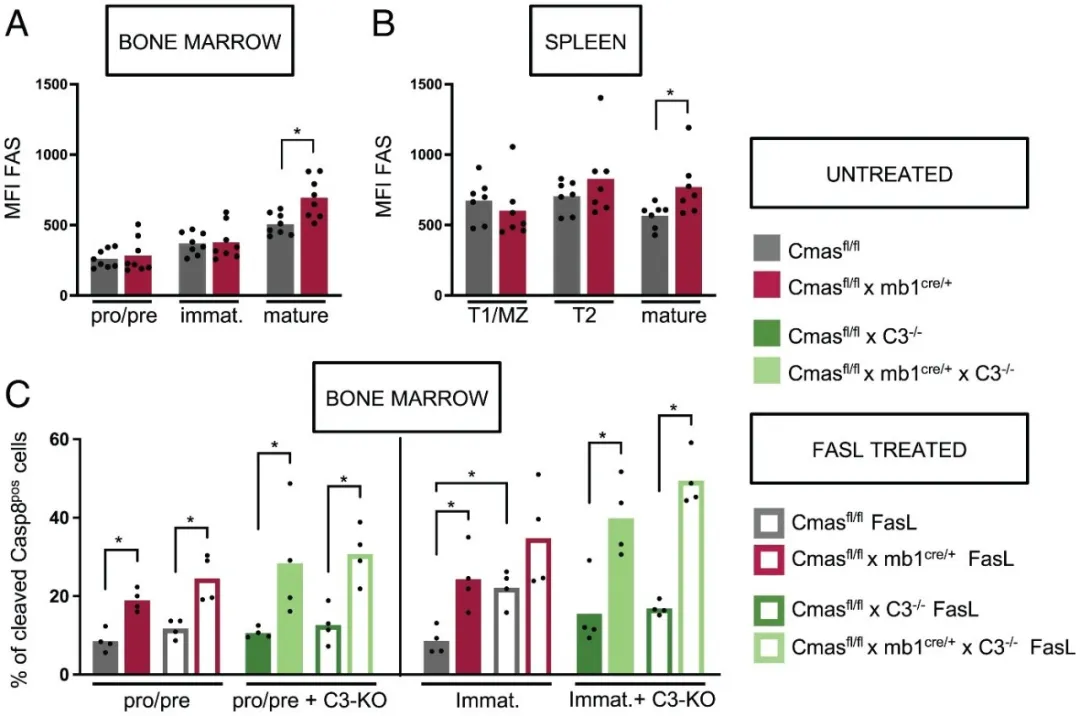
图6:(A-C)Cmas KO小鼠成熟B细胞Fas表达上调。

图7:(C)和(D)培养总骨髓细胞时,Cmas KO小鼠B细胞检测到更高程度的细胞凋亡。
最后,作者基于以上实验数据做出结论,Cmas KO B细胞中发现的高程度细胞凋亡在很大程度上是由外在的凋亡途径触发的,并且这种细胞凋亡诱导不依赖于补体系统。
原文链接:
https://www.pnas.org/doi/abs/10.1073/pnas.2201129119
作者:汪浩
审核:李全才、吕友晶
编辑:邵萌
如有侵权,请联系删除