邮箱地址
前沿资讯
发布时间:2023-11-06 09:05:12 作者:青岛海大海洋寡糖科技有限公司 来源:本站
文章题目:Controlling Nanoparticle Uptake in Innate Immune Cells with Heparosan Polysaccharides
发表期刊:Nano Lett.
影响因子:12.262(2022)
通讯单位:University of Oklahoma


纳米粒(Nanoparticle)在生物医药领域被广泛应用,尤其近几年由于新冠疫情肆虐,脂质纳米粒极大的推动了新冠RNA疫苗的开发和医用。纳米粒可以将药物分子或核酸有效递送至机体细胞,改善传统给药方式的药代动力学表现,提高药物利用度,降低毒副作用。目前临床及临床前研究研究最多的是基于纳米粒的免疫调节、免疫治疗和疫苗接种应用,尤其是在抗肿瘤领域,如何通过纳米粒高效的、特异性的递送目标分子至靶细胞(如癌细胞、免疫细胞等)是目前研究的热点和亟待科学家们回答的难题。
在之前的研究中,研究者们已经开发了基于聚乙二醇PEG修饰的纳米粒,提高纳米粒的亲水性,延长纳米粒血浆半衰期,从而使更多的纳米粒可以递送到肿瘤部位。但近些年的研究发现,由于PEG不是自然界动物体内存在的天然分子,因此其可能存在免疫原性,尤其是大剂量给药的时候,机体会产生抗PEG抗体,加速PEG化纳米粒的血液清除(即ABC现象),同时,PEG分子可能还会导致补体激活,导致ABC现象发生和类过敏反应等。
在该研究团队之前的工作中,他们使用肝素原(heparosan, HEP) 进行纳米粒表面工程改造。与HS不同,HEP未经硫酸化修饰,在细胞外基质中表现为生物惰性,因此HEP改造后的纳米粒子能减少的蛋白冠形成,并与抗原呈递细胞有较好的相互作用[1]。在这篇文章中他们进一步通过确定纳米颗粒的细胞摄取特性和相关的内吞途径,从机制上研究了HEP修饰的纳米粒与先天免疫细胞之间的相互作用,这些发现可能有助于开发安全有效的纳米药物。
本文所用HEP是通过该课题组之前报道的化学酶法合成方法[1],使用PmHS1和UDP供体在HEP三糖胺的基础上通过酶法合成延长糖链获得13 kDa的HEP分子,并在还原端修饰脂肪酸,将合成的HEP锚与金纳米粒孵育获得HEP-AuNPs[2]。
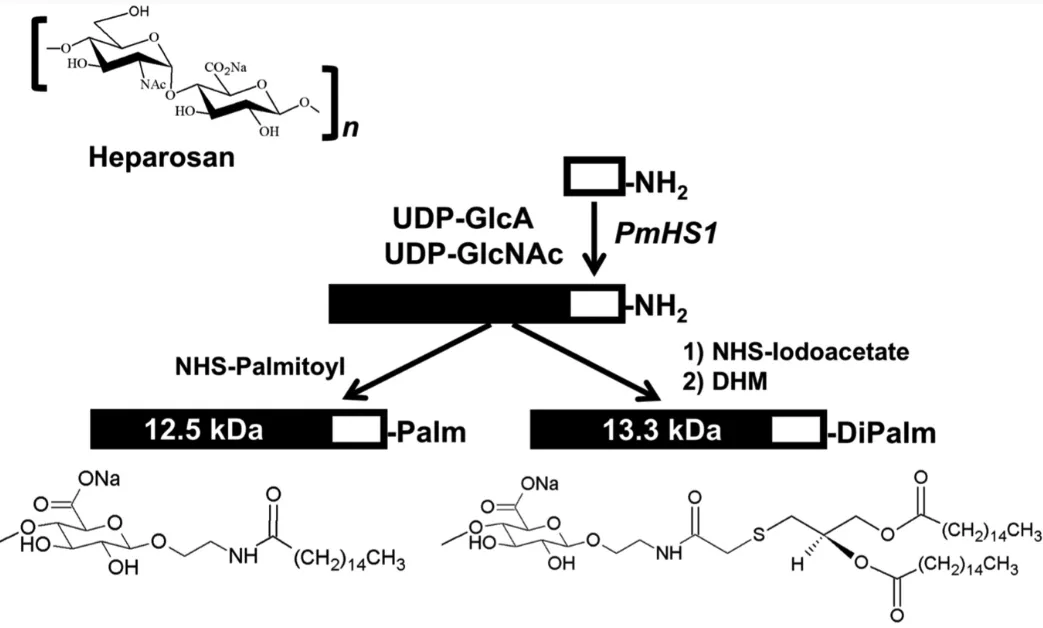
图1. 13 kDa-HEP脂质锚的化学酶法合成
在获得HEP-AuNPs后研究者们使用J774A.1巨噬细胞、RAW 264.7巨噬细胞和DC 2.4树突状细胞分别进行了抗原呈递细胞的摄取实验,实验结果证实HEP-AuNPs能有效的被RAW 264.7巨噬细胞和DC 2.4树突状细胞摄取内化(图2)。
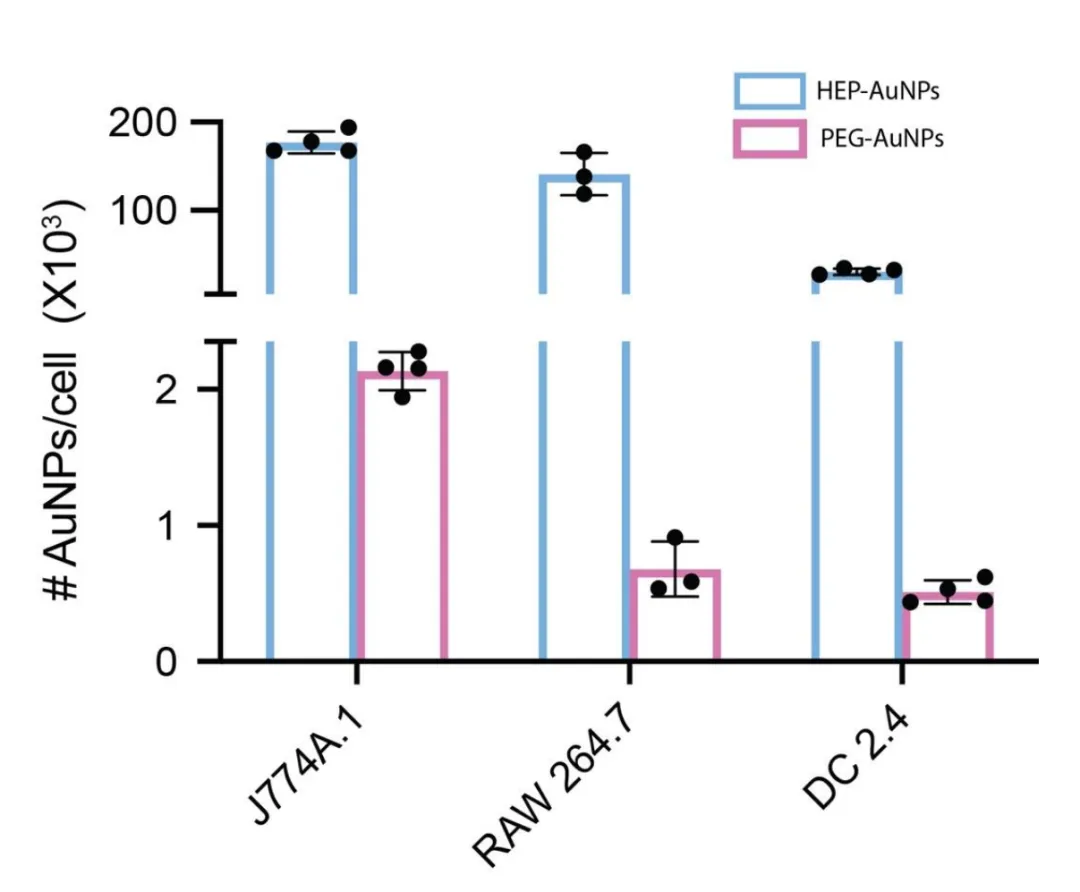
图2. HEP-AuNPs能有些被抗原呈递细胞摄取
为了进一步验证该内化过程是否呈时间依赖性,研究者们通过激光共聚焦扫描显微镜(CLSM)和透射电镜(TEM)观察不同时间点细胞摄取纳米粒的情况,结果证实RAW 264.7巨噬细胞和DC 2.4树突状细胞摄取HEP-AuNPs是时间依赖性的,内化后的纳米粒大部分存在于细胞囊泡内,小部分纳米粒在细胞质中(图3)。
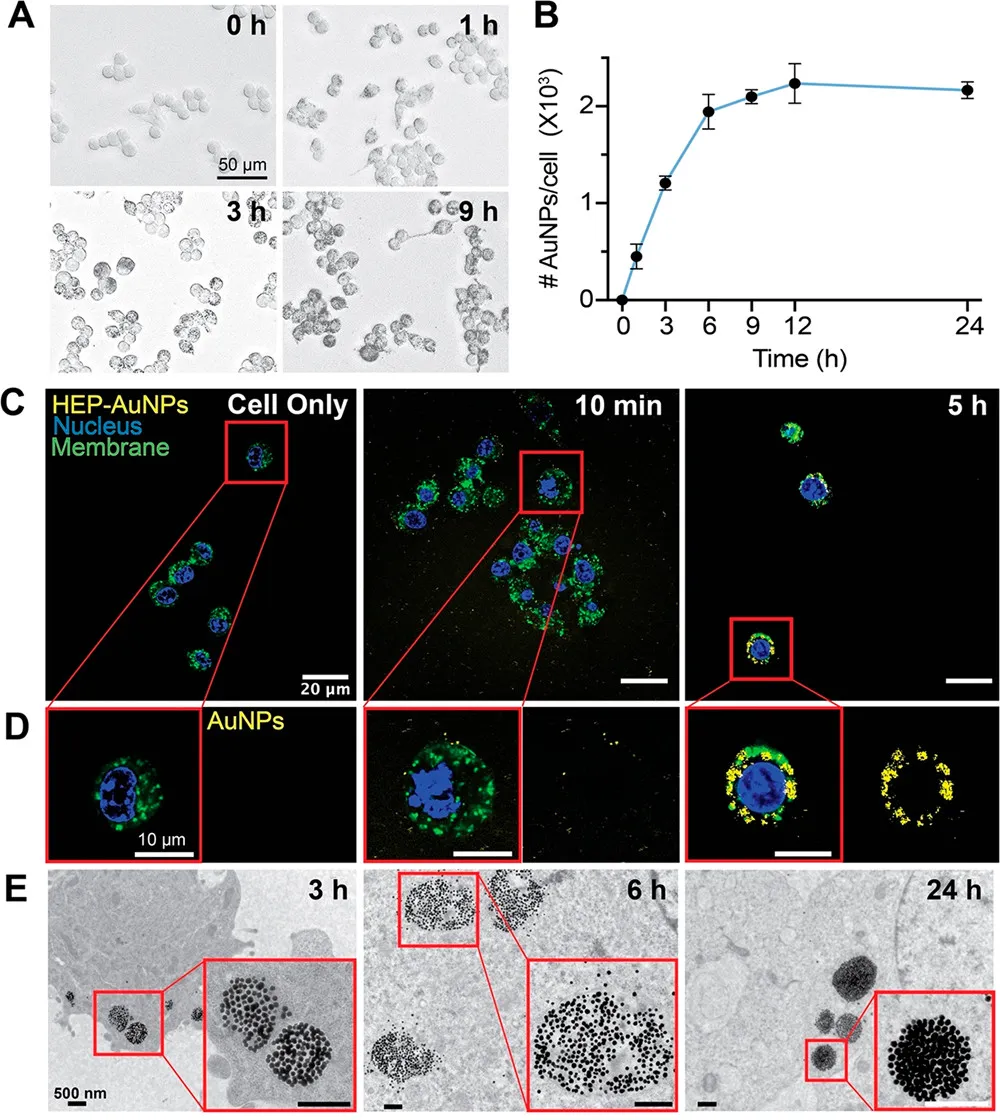
图3. HEP-AuNPs以时间依赖式被细胞摄取内化
将RAW 264.7巨噬细胞在4℃低温或0.1% w/v叠氮钠的非特异性内吞抑制培养条件下与纳米粒孵育,可明显发现纳米粒的摄取减少,证实HEP-AuNPs被细胞摄取的过程是能量依赖的。之后研究者使用多种化学抑制剂(氯丙嗪、氯喹、细胞松弛素D或丙咪嗪等)来筛选纳米粒的内吞途径,结果显示氯丙嗪是最有效的抑制剂,细胞摄取纳米粒下降了约73%(图4)。
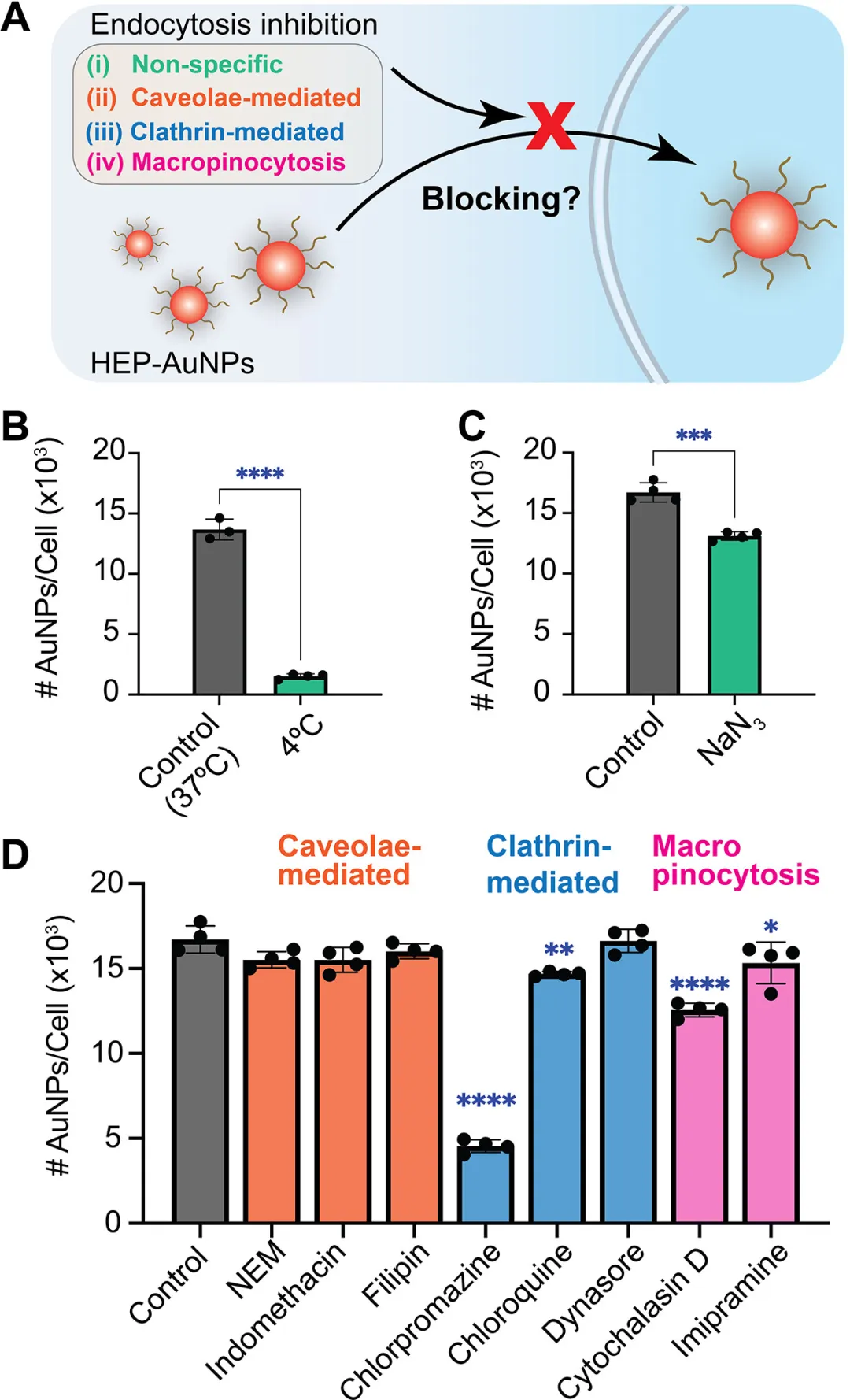
图4. HEP-AuNPs被细胞摄取的过程是能量依赖性的并可被氯丙嗪有效抑制
通过多种化学抑制剂筛选内吞途径,在RAW 264.7和DC 2.4细胞上都证实了HEP-AuNPs被细胞摄取内化的过程主要涉及网格蛋白介导的内吞作用和巨胞饮吞噬作用(图5)。研究者猜想可能是细胞表面特定的受体发挥了重要作用,尤其是与HEP多糖结合相关的受体蛋白。

图5. HEP-AuNPs通过网格蛋白介导的内吞作用和巨胞饮作用被细胞摄取
为了找寻特定的受体蛋白,研究者使用了GAG类化合物库(包括HEP、HA、HS、CSA~CSE、GlcNAc等)竞争性的抑制HEP-AuNPs的细胞摄取,实验结果发现CSA是最有效的抑制剂(~43%),IC50为0.5 mg/mL, 1 mg/mL CSA的抑制作用可持续整个实验时间(24 h),在 2 mg/mL 时,CS A 将 HEP-AuNPs的细胞摄取抑制高达9倍,并且工作浓度下的CSA不影响细胞活力(图6)。然而HEP本身并不能抑制纳米粒与细胞的结合和摄取,他们推测可能是由于HEP-AuNPs与靶细胞结合的多价效应过强,无法被游离的HEP有效竞争抑制导致。
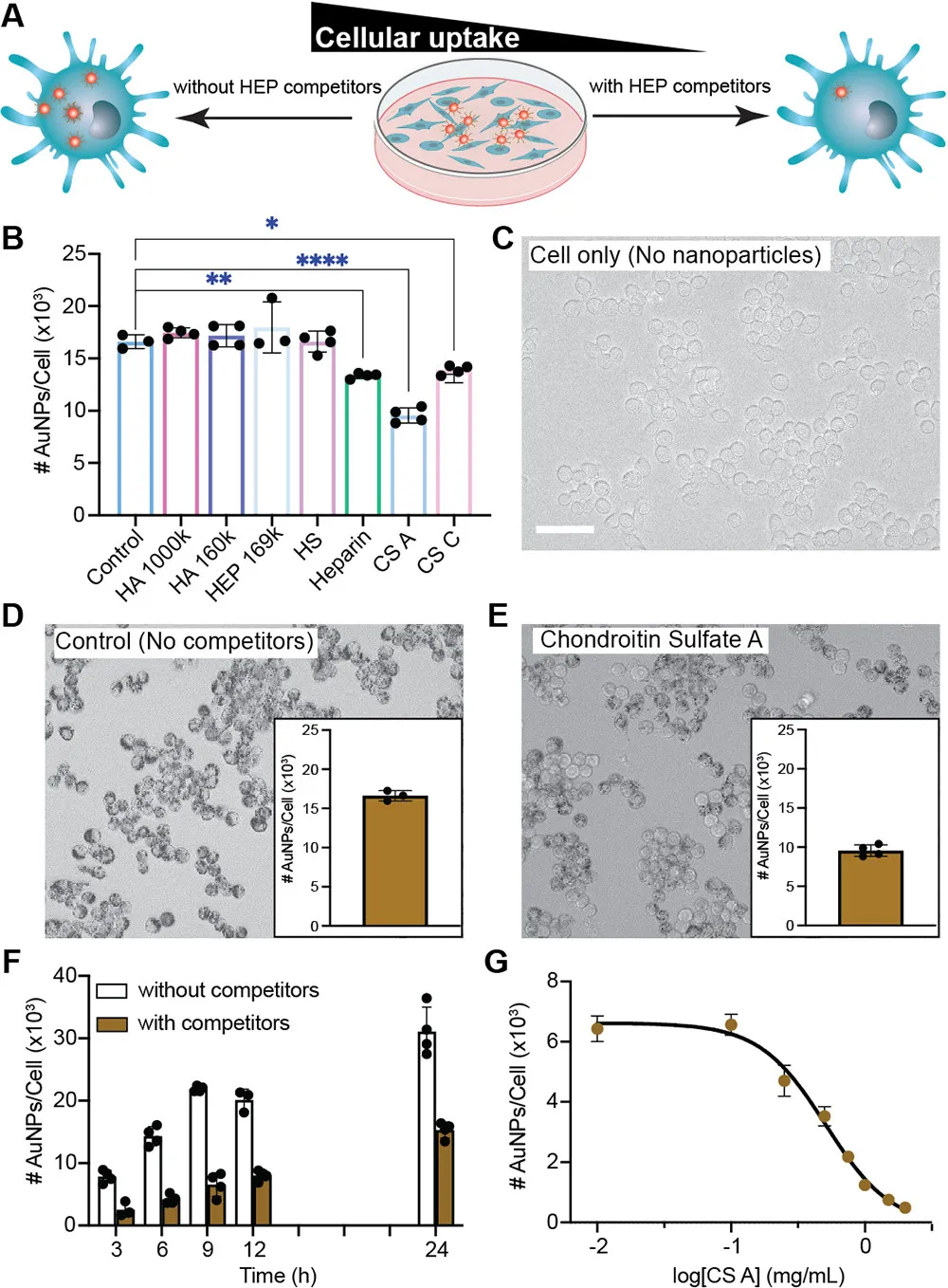
图6. 评价GAG类化合物尤其是CSA竞争性抑制HEP-AuNPs细胞内吞的效果
最后,研究者们评估了不同HEP修饰密度的纳米粒对内吞过程的影响,使用PEG来填充不被HEP修饰的部分,避免纳米粒本身容易出现的胶体不稳定现象和蛋白冠的形成,研究结果表面通过调控纳米粒表面HEP修饰密度能够将纳米粒的细胞摄取率调控在3个数量级之内,证实了HEP-AuNPs是通过多价效应与细胞结合并被摄取内化的(图7)。
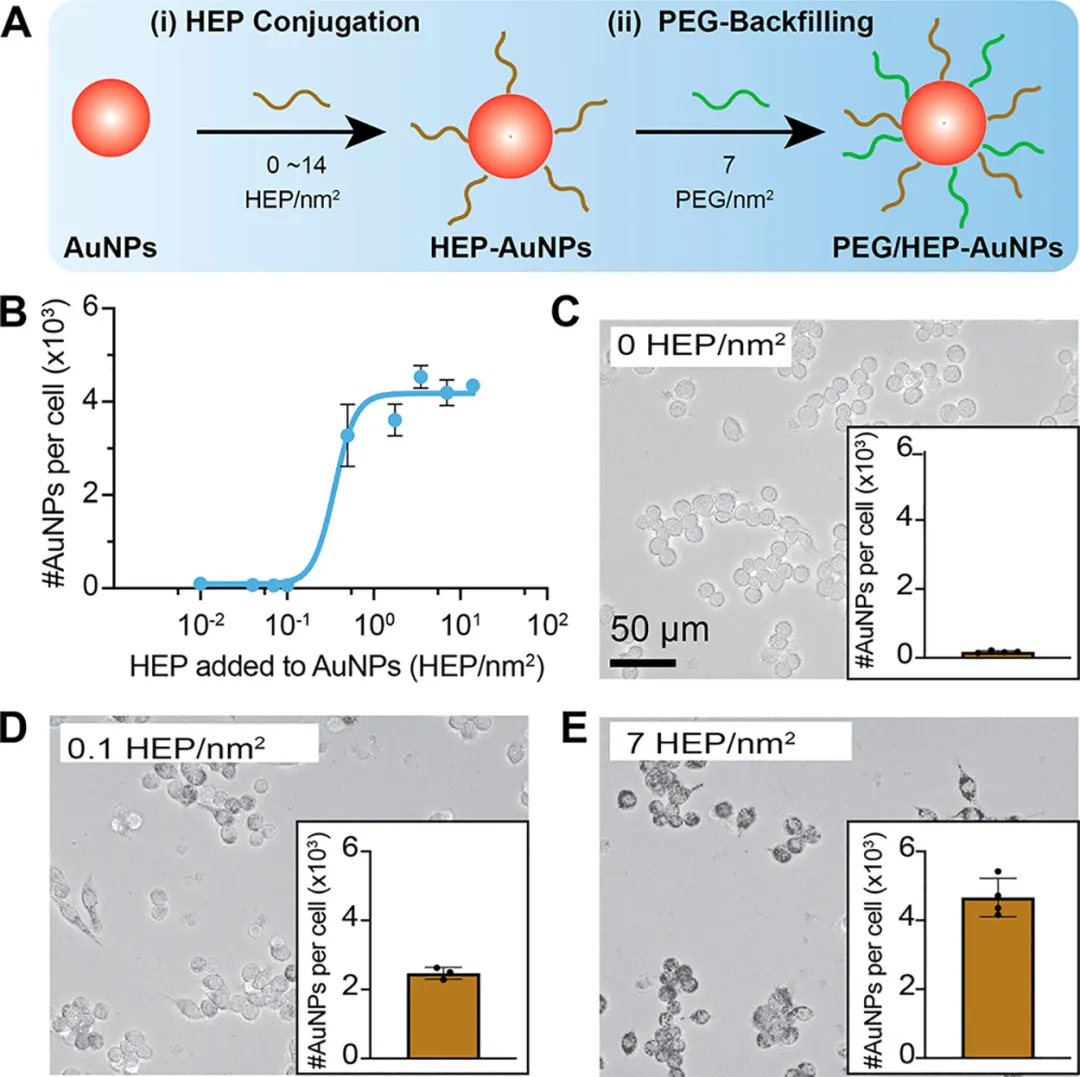
图7. 控制HEP-AuNPs表面HEP修饰度能控制细胞摄取率
综上所述,在这篇文章所报道的工作中,研究者们针对HEP修饰的纳米粒HEP-AuNPs进行了系统的先天免疫细胞的摄取内吞研究,他们的研究结果表明HEP-AuNPs以时间依赖和能量依赖的方式被细胞内吞,并通过网格蛋白的内吞作用和巨胞饮吞噬作用内化到细胞内的囊泡中,该过程是纳米粒表面的HEP通过多价效应与细胞表面受体蛋白结合介导的,调控HEP的修饰密度可以控制纳米粒的细胞摄取率。较为遗憾的是,该过程中涉及的细胞表面受体蛋白仍未被明确阐述,需要后续研究深入挖掘。
参考文献:
[1] Lane, R. S.; Haller, F. M.; Chavaroche, A. A. E.; Almond, A.; DeAngelis, P. L. Heparosan-Coated Liposomes for Drug Delivery. Glycobiology2017, 27 (11), 1062–1074.
[2] Zhang, X.; Servos, M. R.; Liu, J. Instantaneous and Quantitative Functionalization of Gold Nanoparticles with Thiolated DNA Using a PH-Assisted and Surfactant-Free Route. J. Am. Chem. Soc. 2012, 134 (17), 7266–7269.
原文链接:
https://doi.org/10.1021/acs.nanolett.2c02226
作者:王礼浩
审核:李全才,吕友晶
编辑:邵萌
如有侵权,请联系删除