邮箱地址
前沿资讯
发布时间:2023-10-16 15:27:46 作者:青岛海大海洋寡糖科技有限公司 来源:本站
文章题目:An adjuvant strategy enabled by modulation of the physical properties of microbial ligands expands antigen immunogenicity
发表期刊 : Cell
影响因子 : 66.85(2021)
通讯单位 : Harvard Medical School

C型凝集素受体通过识别细胞壁多糖来调节真菌感染过程中的先天和适应性免疫反应,其中Dectin-1(Clec7a)和Dectin-2(Clec4n)分别被β-葡聚糖和甘露聚糖激活。这些真菌多糖不仅化学结构不同,而且物理性质也存在差异,但是目前多糖配体的物理特性对免疫反应的影响仍然缺乏相关研究。
在本文的研究中,作者发现多糖配体的大小和溶解度决定了免疫反应,可溶性甘露聚糖并不能在皮肤等外周组织中激活免疫系统,但会在引流淋巴结 (dLN) 中通过释放干扰素引发有效的免疫反应;通过与明矾相结合来调整甘露聚糖物理特性,则成功引起了皮肤炎症。作者通过将明矾/甘露聚糖作为佐剂与病毒抗原蛋白相结合,有效拓宽了抗体的表位特异性,并对病毒感染提供保护。

图1:β葡聚糖引起皮肤炎症,并通过DC细胞介导的运输作用,富集于淋巴结;可溶性甘露聚糖直接富集于淋巴结,并通过CD169高表达的巨噬细胞,激活下游免疫细胞;明矾/甘露聚糖制剂,既能够激活皮肤中DC细胞,也能够直接富集于引流淋巴结,引发有效的免疫应答,产生能够针对广泛抗原表位的抗体。
作者使用了从白色念珠菌中分离出来的β-葡聚糖(直径500 nm,不溶)和甘露聚糖(直径20nm,可溶)。其中,皮下注射β-葡聚糖后会引起皮肤炎症的发生,而甘露聚糖则不会引起此类炎症(图2A, B),与此相对甘露聚糖能够更快的富集于引流淋巴结中(图2C),并以干扰素依赖性的方式激活免疫细胞,促进淋巴结的扩增(图2D-K)。
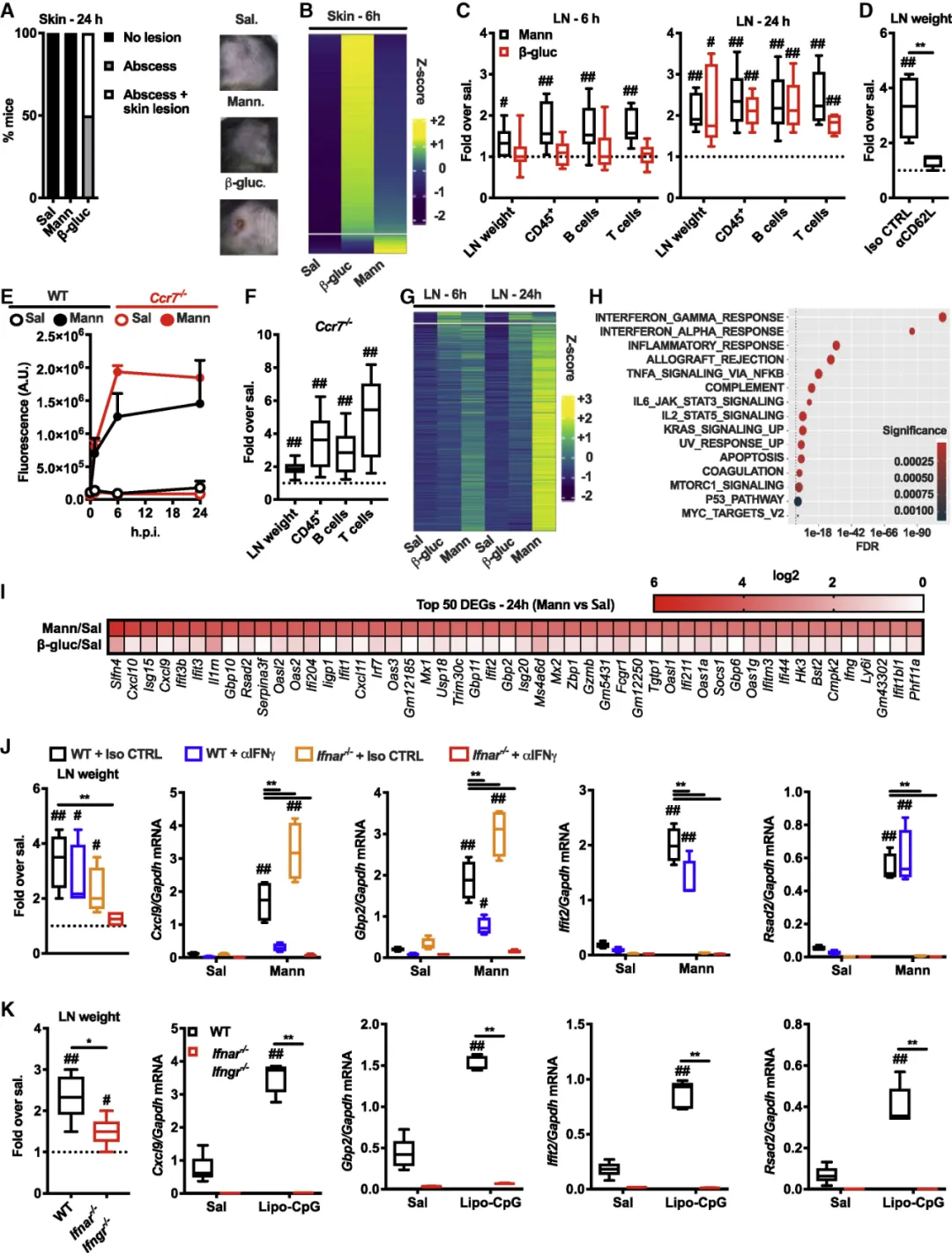
图2:(A)注射24h后,小鼠皮肤炎症比较;(B)注射6h后皮肤样本的转录组分析;(C)注射6h和24h后引流淋巴结中,β-葡聚糖和甘露聚糖的富集情况;(D)甘露聚糖引流至淋巴结依赖于白细胞循环;(E)甘露聚糖在野生型小鼠和Ccr7-/-小鼠淋巴结中的富集情况;(F)注射甘露聚糖24h后,Ccr7-/-小鼠淋巴结中免疫细胞的变化情况;(G)注射6h和24h后转录组分析;(H)属于(G)中描述的被甘露聚糖上调的基因的通路富集分析;(I) 注射甘露聚糖24小时后的引流淋巴结中,前50个基因的平均表达水平的热点图;(J)和(K)注射抗IFNγ阻断抗体 (αIFNγ) 、Lipo-CpG或相同剂量的同种型对照 (Iso CTRL)后,基因表达分析。
接下来,作者对甘露聚糖激活免疫系统的机制进行了探究。发现Dectin-2及其共同受体FcRγ是甘露聚糖引发的淋巴结扩增和激活干扰素刺激基因(ISG)所必需(图3A-E)。其中CD11b+CD11c+Dectin-2+并且高表达CD169的髓窦巨噬细胞在此过程中也发挥着重要作用(图3F-L),清除此类细胞完全抑制了甘露聚糖引发的淋巴结扩增和ISG诱导(图3M)。
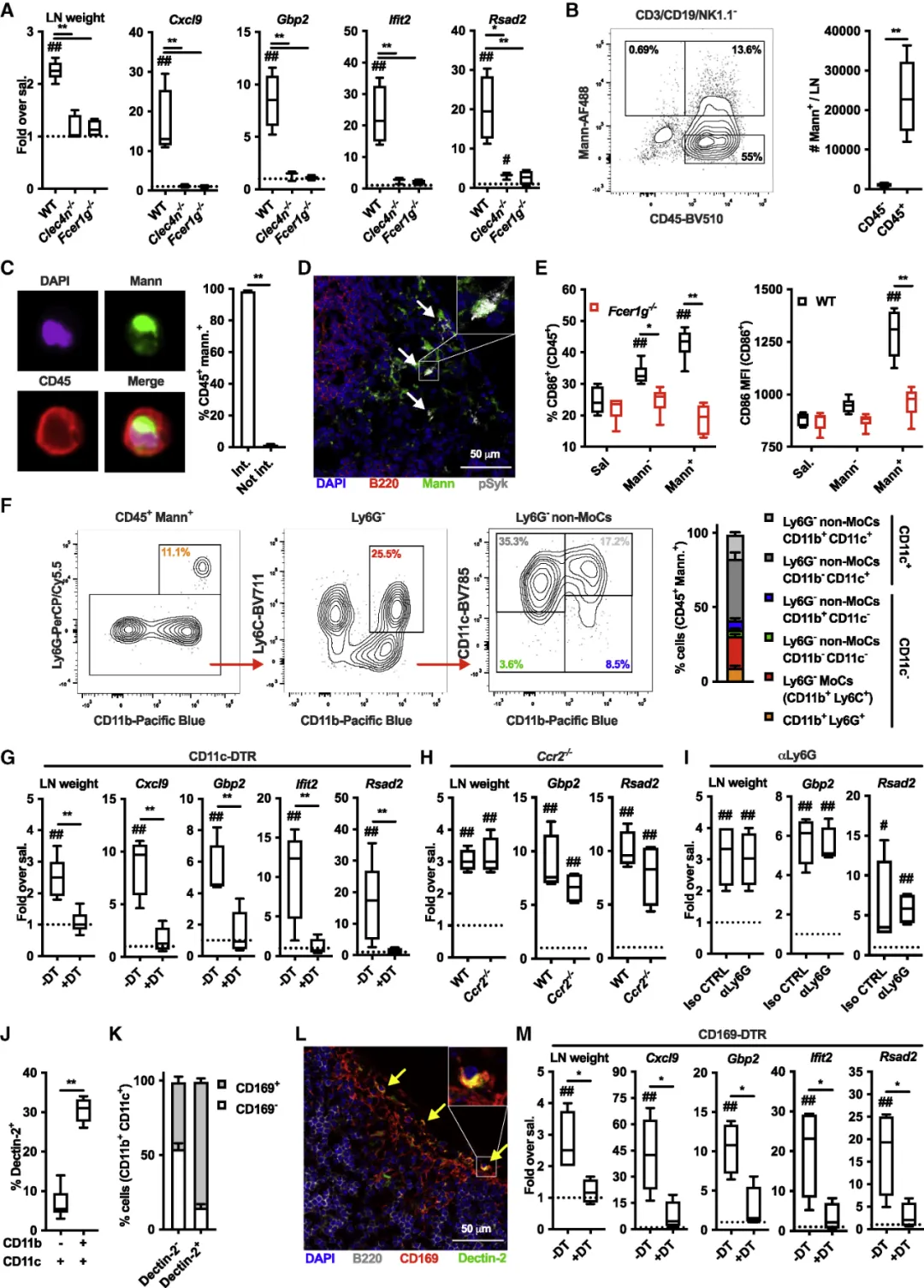
图3:(A)野生型、Clec4n-/-以及Fcer1g-/-小鼠注射甘露聚糖后淋巴结重量以及基因表达分析;(B)流式细胞仪对载满甘露聚糖的CD3/CD19/NK1.1细胞的数量进行分析;(C)CD3/CD19/NK1.1细胞对甘露聚糖的内化情况;(D)共聚焦显微镜分析显示p-Syk 和甘露聚糖的共定位;(E)野生型、Fcer1g-/-小鼠注射甘露聚糖后,摄取或者不摄取甘露聚糖细胞的CD86表达情况;(F)流式细胞术评估 CD3/CD19/NK1.1-CD45+含有甘露聚糖细胞的表型;(G-I)白喉毒素 (DT) 处理的CD11c-DT受体 (DTR)、Ccr2-/-和同种型对照 (Iso CTRL)- 或抗 Ly6G (αLy6G) 处理的小鼠注射甘露聚糖后淋巴结重量以及基因表达分析;(J)和(K)流式细胞术分析Dectin-2的表达,以及CD169+在CD3/CD19/NK1.1-CD45+细胞亚群中表达的百分比;共聚焦显微镜分析证实了 CD169 和Dectin-2 在LN包膜下窦内衬细胞上的共定位;(M)白喉毒素 (DT) 处理的鼠注射甘露聚糖后淋巴结重量以及基因表达分析。
尽管已经证明了Dectin-2以及高表达CD169的巨噬细胞在甘露聚糖激活免疫系统的关键作用,但是在Card9-/-小鼠模型中,I型IFN依赖性基因没有明显变化,并且II型IFN依赖性ISG尽管与野生型小鼠相比显着降低,但仍然被部分诱导(图4A)。进一步研究发现,在非经典NF-κB转录因子RelB选择性敲除的小鼠中,甘露聚糖诱导的淋巴结扩增以及I型和II型IFN依赖性ISG的表达均显着降低(图4C,D),这说明RelB调节了甘露聚糖刺激引起的IFN依赖性ISG的高表达,并维持淋巴结的扩增。
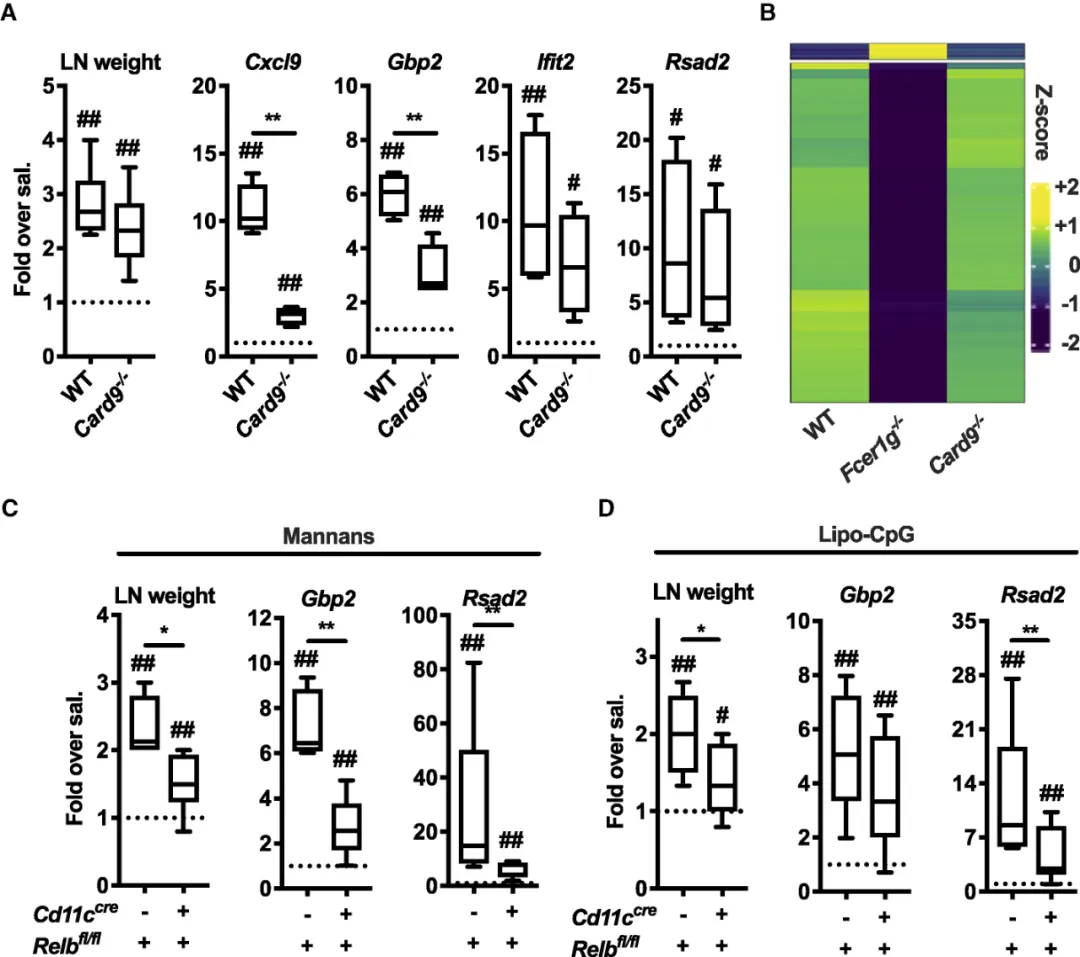
图4:(A)野生型和Card9-/-小鼠注射甘露聚糖后淋巴结重量以及基因表达分析;(B)野生型、Fcer1g-/-和Card9-/-小鼠转录谱分析;(C)和(D)Relbfl/fl and Cd11ccreRelbfl/fl小鼠注射甘露聚糖后淋巴结重量以及基因表达分析。
为了进一步调节甘露聚糖的物理性质,作者利用氢氧化铝来吸附甘露聚糖,从而获得了同时含有可溶和不可溶的甘露聚糖的制剂(明矾/甘露聚糖),动物模型结果显示,明矾/甘露聚糖不仅会引发皮肤炎症(图5A),而且还会更有效的方式富集于淋巴结(图5B),并且以干扰素依赖性方式(图5E,F)促进淋巴结的扩增(图5C)以及ISG的诱导表达(图5D)。
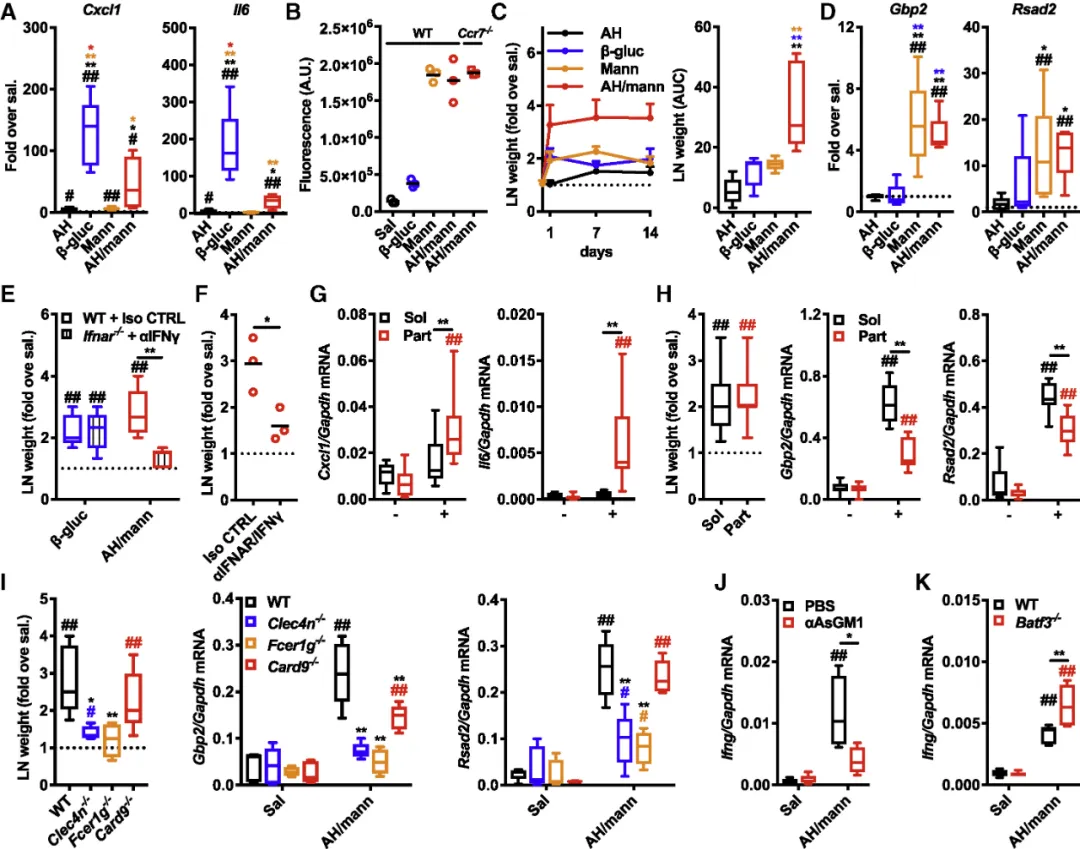
图5:(A)小鼠皮肤样本基因表达分析;(B)野生型小鼠和Ccr7-/-小鼠注射聚糖24h后淋巴结中聚糖含量分析;(C)注射后淋巴结重量检测(D)小鼠淋巴结基因表达分析;(E)用阻断性抗IFNγ抗体 (αIFNγ) 或相同剂量的同种型对照 (Iso CTRL) 处理后,小鼠引流淋巴结中量;(F)用阻断性 anti-IFNAR plus anti-IFNγ (αIFNAR/IFNγ) 抗体或相同剂量的同种型对照 (Iso CTRL) 处理后,小鼠引流淋巴结重量。
作者继续研究了明矾/甘露聚糖作为佐剂在动物模型中的应用,将SARS-CoV-2的Spike蛋白与明矾/甘露聚糖相结合作为疫苗免疫老鼠,发现含有Spike/明矾/甘露聚糖的疫苗,诱导产生了最高水平的抗Spike和抗RBD的抗体(图6A,B),并且在假病毒和真病毒中和实验中,表现出最高水平的中和能力(图6D,E)。进一步研究发现,Spike/明矾/甘露聚糖的疫苗诱导的抗体能够更好的识别不同冠状病毒Spike蛋白上的特定表位(图6I),即产生具有广泛表位特异性的中和抗体。
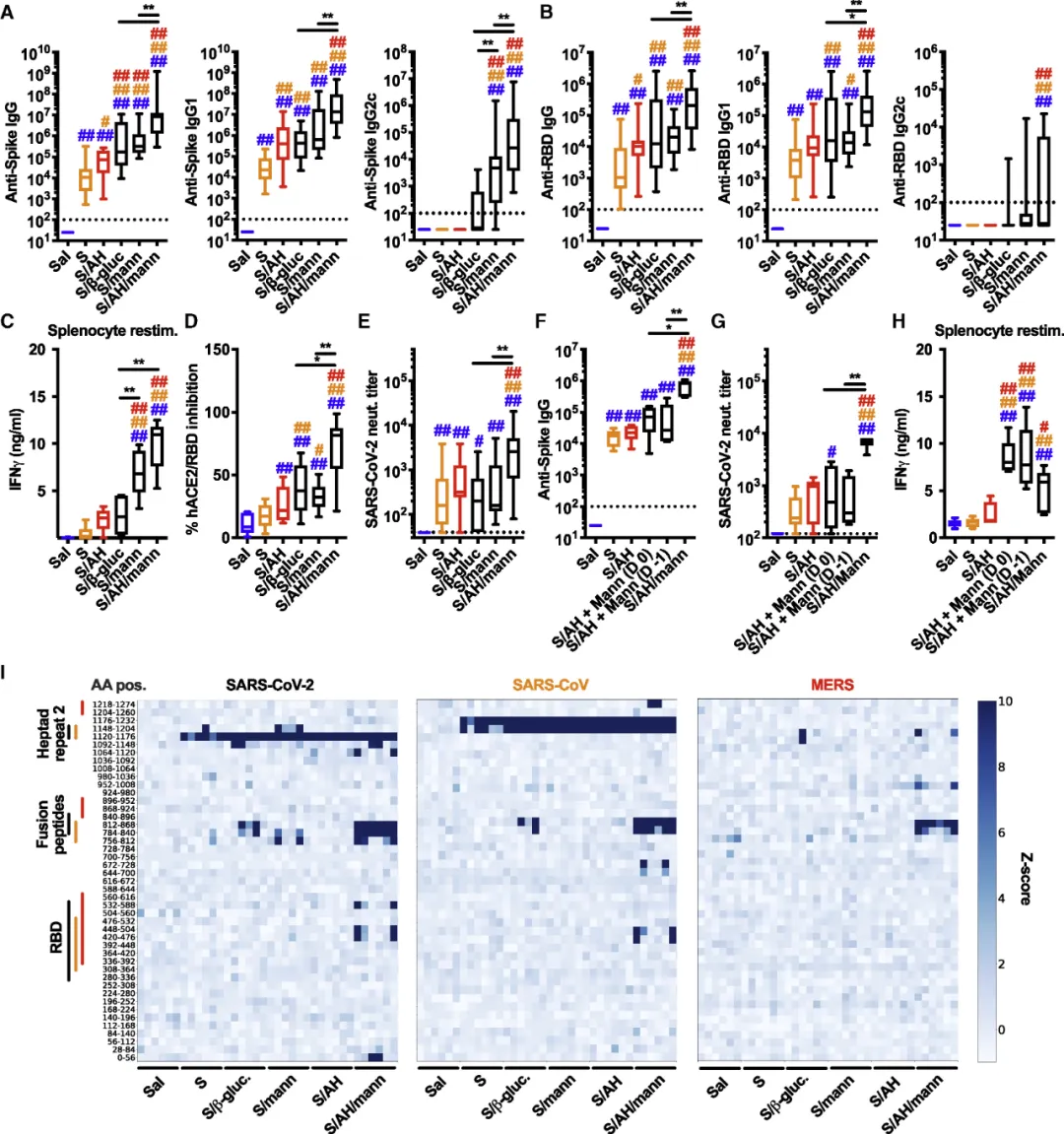
图6:(A-B)免疫28天后,小鼠血清中anti-Spike和anti-RBD的滴度;(D)和(E)假病毒和真病毒中和试验;(I)第 28 天收集的血清样品进行VirScan 分析。
最后,作者发现明矾/甘露聚糖制剂不仅可以促进针对靶抗原的强烈抗体反应,而且可以促进高突变性甲型流感疫苗免疫后的异亚型免疫,使用Flublok/明矾/甘露聚糖免疫的小鼠,不仅产生了高滴度的抗HA抗体(图7C),并且实现了rPR8流感病毒(Flublok不含有该毒株抗原)的有效保护(图7D-F)。

图7:(C)第 28 天收集血清样本中抗rHA抗体滴度;(D)免疫小鼠后,35天试用rPR8病毒感染老鼠,并记录老鼠体重(E)第 28 天收集血清样本中抗rPR8病毒抗体滴度;(F)按照(D)处理小鼠肺部组织切片。
原文链接:
https://doi.org/10.1016/j.cell.2022.01.009
作者:汪浩
审核:李全才,吕友晶
编辑:邵萌
如有侵权,请联系删除