邮箱地址
前沿资讯
发布时间:2024-06-17 09:26:20 作者:青岛海大海洋寡糖科技有限公司 来源:本站
文章题目:Interaction of beta-glucans with gut microbiota: Dietary origins, structures, degradation, metabolism, and beneficial function
发表期刊:Critical Reviews in Food Science and Nutrition
影响因子:11.208
通讯单位:国家食品科学与资源重点实验室,江南大学食品科学与技术学院

β-葡聚糖(BG)是一种由通过β-糖苷键连接的界面葡萄糖单体组成的多糖,根据其与肠道微生物群的相互作用,可定义为一种具有高度特异性的膳食纤维。它可以诱导类似的个体间微生物群反应,从而对人体产生有益影响。本文综述了BG的四种主要来源(谷物、真菌、藻类和细菌)及其在结构和含量上的差异。
BG与肠道微生物群的相互作用及其对健康的影响至关重要,包括增强免疫、调节血清胆固醇和胰岛素水平、减轻肥胖和改善认知障碍。近年来,BG与肠道微生物群相互作用的研究进展迅速。图1显示了从VOS查看器获得的过去二十年的研究热点图。随着我们理解的不断加深,热点逐渐从“性状、dectin-1、饮食和细胞”扩展到“免疫、生长性能和消化率”,这表明BG的挖掘和肠道功能受到了更广泛的关注。先前已经总结了关于BGs不同方面的信息,包括修饰和生理功能,如免疫调节、抗肿瘤和抗炎作用,以及降低血清胆固醇水平。据报道,作用机制主要由个体中的细胞因子和激素介导,也和肠道微生物密切相关。

图1. 从 2000.1 到 2022.10 的 β-葡聚糖关键字聚类图(数据是通过在 Web of Science 中搜索以 β-葡聚糖和肠道微生物群为关键字获得的)。(a)按时间分组;(b)按密度聚类
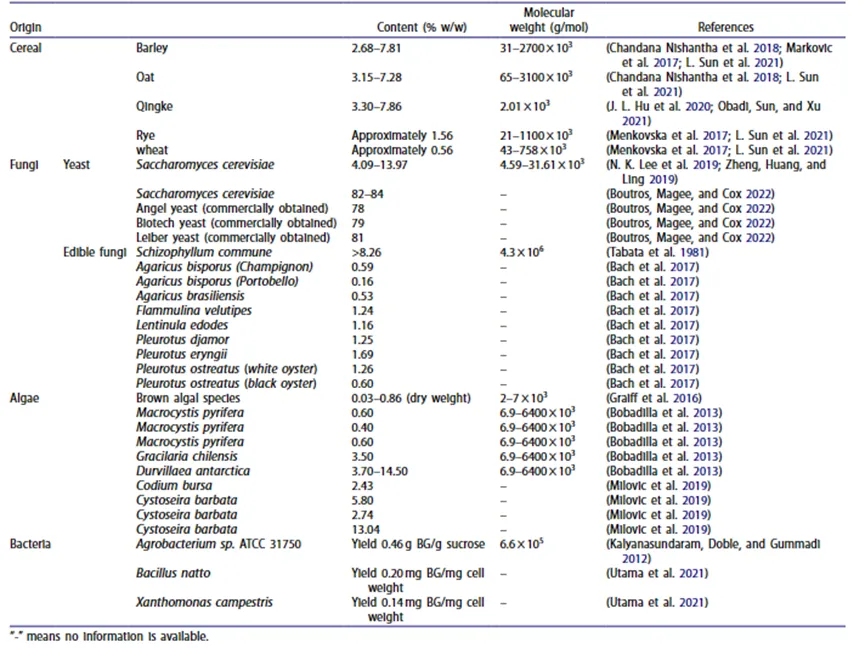
BG来源多种多样,分为以下四大类:谷物、真菌、藻类和细菌。表1显示了BG的不同来源以及所占质量百分比和分子量。谷物是最常见的来源,BG主要存在于胚乳、胚乳层和亚白杨酮层中。BG是酵母和大型食用菌中细胞壁多糖的主要成分,约占细胞壁的50%。通常,酵母(YBG)中β-葡聚糖的比例高于食用菌。藻类中BG的含量从0.4%到14.5%不等,这取决于藻类的种类。细菌分泌的细胞外多糖也是β-葡聚糖的重要来源。由于β-葡聚糖是一种分泌在细菌细胞壁外的次级代谢产物,因此主要报道其产量,而不是质量百分比。
表1 β-葡聚糖的来源、含量和分子量
不同来源的β-葡聚醣含有不同的β-糖苷键,导致一级结构存在差异,如图2所示。BG结构的差异导致其理化性质和功能活性的差异。首先,分子量(Mw)和聚合度(DP)通常决定多糖的粘度和溶解度。对于高度聚合物,粘度通常与其Mw成正比,DP>100的BG通常是不溶性纤维。从藻类中提取的BG具有较低的Mw(范围从3400到7700 Da)和低DP,因此显示出很强的溶解度.同时,稳定的三螺旋结构的形成也需要多糖达到一定的Mw,例如,裂叶聚糖的总Mw应超过5000Da才能形成三螺旋。相比之下,来自海带的海燕胶粘合糖通常仅作为单链存在,具有免疫潜力的产品需要最小分子大小为1 kDa才能具有生物活性,三螺旋结构决定了BGs的免疫调节和抗癌特性,因此,Mw和3D结构的差异导致不同BG的功能活性存在差异。
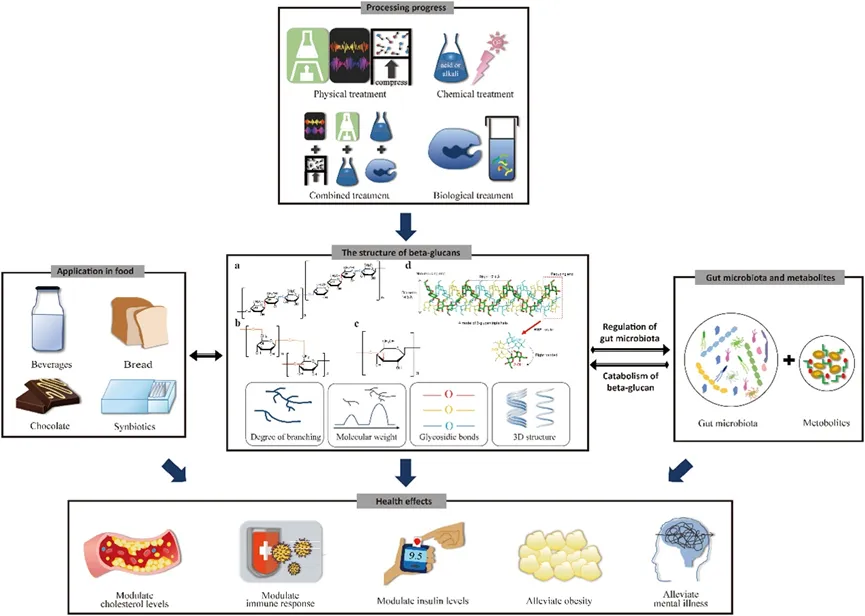
图2 β-葡聚糖研究的范围,涉及制备过程,在食品中的应用,肠道微生物群的调节和健康影响。(a)谷物衍生的线性β-1,3-1,4-葡聚糖,通常为1至4个β-1,3-糖苷键,与一个β-1,6-糖苷键交替,但没有β-1,3-糖苷键。(b)真菌衍生和藻类衍生的β-葡聚糖,具有β-1,6主链和具有β-1,3长链(酵母)或短链(食用真菌)的侧链。(c)细菌衍生的线性β-1,3-葡聚糖(Curdlan)。β-1,4-、β-1,6-和β-1,3-糖苷键分别以红色、蓝色和橙色显示。(d)右旋三螺旋β-1,3-葡聚糖模型,估计螺旋间距为17.4Å,直径为14.3Å
作为一种膳食纤维,BG不被人体消化吸收,而是被肠道微生物群代谢。近年来的几项研究集中在膳食纤维和肠道微生物群之间的相互作用上。食用不同纤维的处理导致遗传相同小鼠的肠道微生物组在群落丰富度和细菌分类丰度水平上发生变化,以及肠道微生物群差异的个体在饮食主要由特定纤维组成时表现出不同的代谢结果。因此,膳食纤维可以在一定程度上调节肠道菌群的多样性、丰富性和群落组成,影响代谢物质的产生,而菌群又会作用于纤维分解代谢,最终表现为膳食纤维与肠道菌群的相互作用。
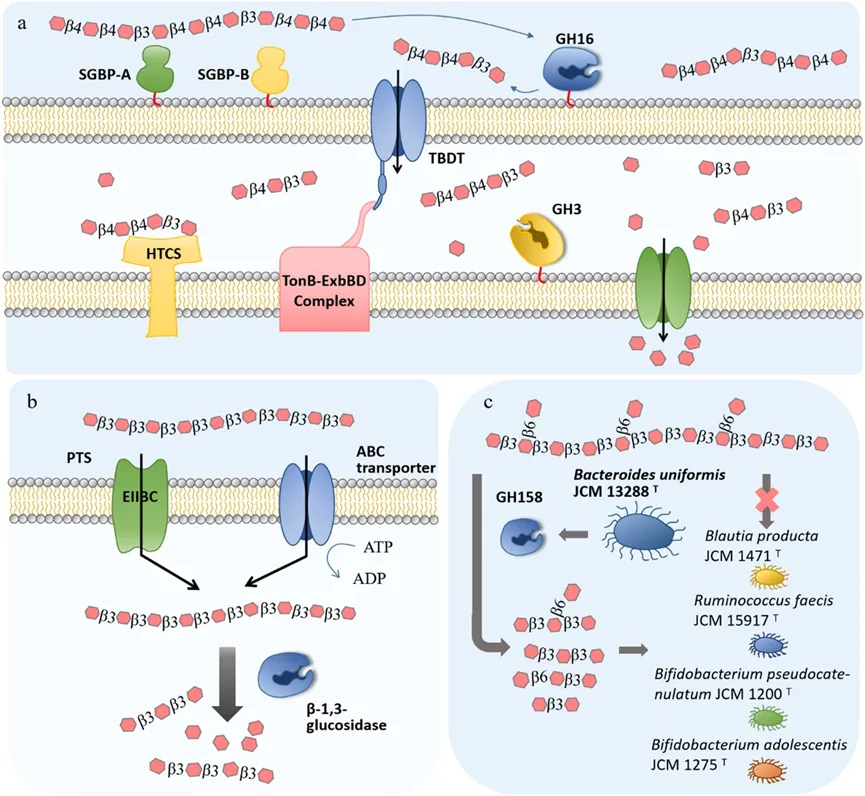
图3 肠道微生物群降解β-葡聚糖的可能模型。(a)卵形拟杆菌降解谷类BG的模型.(b)长双歧杆菌婴儿双歧杆菌降解BG的模型.(c)均匀拟杆菌与肠道中其他细菌交叉喂养的藻类BG降解模型。
BGs已被证明具有降低餐后血糖水平和降低血浆胆固醇等功能,这些健康影响的潜在机制被认为是直接和间接影响的结合。即BGs通过上消化道对宿主有直接影响,如与受体细胞结合;此外,由于人体内缺乏利用包括BG在内的膳食纤维的酶,大多数BGs是由定植于下消化道的肠道微生物群合成的CAZymes发酵的,从而引起肠道微生物群的变化并影响肠道功能。
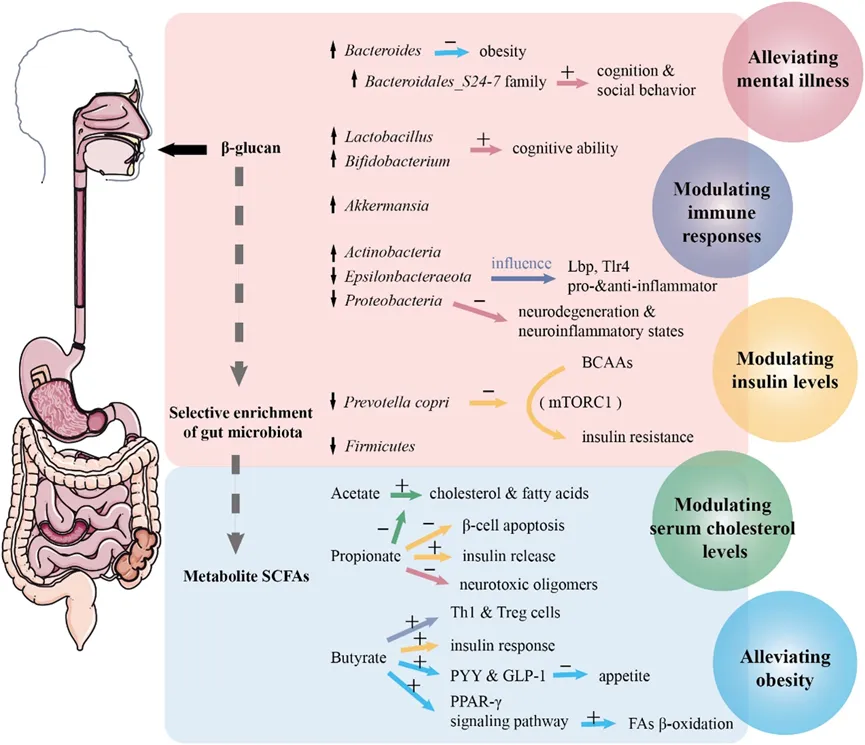
图4 BGs对微生物群相关功能的益生元和生理作用
本文综述了BG与肠道菌群相互作用的研究进展,以及BG对微生物相关功能的健康影响。此外,不同来源的BG在结构上存在明显差异。目前的研究表明,具有不同分子结构的BGs对肠道微生物群和健康有不同的影响,但仍需要更深入地挖掘所涉及的机制。未来的研究应侧重于探索肠道细菌代谢BGs的机制,并比较不同结构BGs的功能差异。这将有助于丰富饮食调节肠道菌群的研究,例如开发含有不同来源BGs的功能性食品,或开发由BGs及其靶向益生菌组成的微生物制剂,这将有助于临床选择合适的BGs作为补充剂,以防止健康缺陷或改善健康状况。
原文链接:https://doi.org/10.1080/10408398.2023.2217727
作者:李鑫
审核:李全才
编辑:邵萌
如有侵权,请联系删除